INTOXICACIONES Y ENVENENAMIENTOS
En
México, las intoxicaciones representan un problema de salud pública ya que, por
un lado, constituyen una causa común de solicitud de atención médica de
urgencias en la mayoría de los hospitales, y por el otro, existe un subregistro
de las mismas por el poco reconocimiento por parte del personal de salud de la
atención médica de primer contacto.
El
abordaje diagnóstico y el tratamiento del paciente intoxicado, en la mayoría de
los casos es complicado, ya que existen discrepancias importantes en el tratamiento
inicial, que se describe en la literatura médica.
En
México, la información sobre intoxicaciones y envenenamientos es escasa y
dispersa y, sobre todo, no existe una cátedra de Toxicología en las
universidades del país.
Las
intoxicaciones y envenenamientos agudos son, en su mayoría, verdaderas
emergencias médicas que potencialmente ponen en peligro la vida o la integridad
funcional del paciente intoxicado. De ahí que sea prioritario salvar su vida y
continuar la atención médica hasta que sus funciones se estabilicen y las
complicaciones sean corregidas. Posteriormente, se llevarán a cabo los procesos
de detoxificación correspondientes a cada caso.
En la
última década se estableció uno de los avances más importantes en el
tratamiento de las intoxicaciones, al ser consideradas como verdaderos
"Traumas múltiples de origen químico" lo que ha permitido aplicar
todas las técnicas de apoyo vital básico y avanzado, como en cualquier trauma
para, prioritariamente, salvar la vida del paciente antes de eliminar o
inactivar el tóxico o veneno.
El
tratamiento racional de las intoxicaciones se ha sistematizado, al dividirlo en
tres fases consecutivas:
FASE DE EMERGENCIA:
También llamada Fase de Apoyo Vital Básico. En esta fase se proporciona
atención inmediata al paciente en el sitio donde ocurrió la intoxicación, se
retira al paciente de la fuente de exposición, se inicia la descontaminación y
se inician maniobras de reanimación básica.
FASE DE APOYO VITAL AVANZADO: Esta
segunda etapa se debe llevar a cabo en los servicios de urgencia; su objetivo
es perpetuar la vida del paciente mediante técnicas avanzadas de reanimación
cardiopulmonar.
FASE DE DESCONTAMINACION Y DETOXIFICACIÓN: Con el
paciente estable en sus funciones vitales, se procederá a realizar una
descontaminación efectiva, administración de antidotos y antagonistas, según
sea el caso, y a iniciar medidas de eliminación del tóxico.
Se
recomienda el abordaje inicial del paciente intoxicado en el ámbito
extrahospitalario como se señala en el Algoritmo 1.
El
Soporte Vital Básico de Vida en el paciente intoxicado inicia con el mismo
orden que en la EVALUACIÓN PRIMARIA del paciente con trauma, siguiendo, de
manera ordenada, los siguientes pasos:
- A (Abrir vía aérea y control columna cervical)
- B (Ventilación y administración de oxígeno)
- C (Control de hemorragias externas y reconocimiento de hemorragias internas)
- D (Déficit neurológico)
- E (Exposición del paciente y vigilancia de hipotermia)
Una vez estabilizado el paciente en sus funciones vitales, se realizará una evaluación secundaria, siguiendo los siguientes pasos, de manera ordenada:
- A (Control avanzado de la vía aérea-intubación selectiva-)
- B (Revisión y modificación de dispositivos de oxigenación)
- C (Colocación de línea endovenosa, administración de soluciones parenterales y colocación de aditamentos para monitoreo cardiorrespiratorio)
- D (Descontaminación)
- E (Eliminación Facilitada)
- F (Focused Therapy o Terapia Específica)
- G (Get Tox. Help o llamar y/o trasladar con el experto en Toxicología)
En un
alto porcentaje de pacientes intoxicados, el soporte básico de vida acompañado
de una adecuada reanimación hídrica, electrolítica y ácido base, suelen ser
suficientes para la estabilización.
Para el
abordaje terapéutico del paciente intoxicado es fundamental reconocer las
características toxicocinéticas y toxicodinámicas del producto tóxico al que se
esté enfrentando.
Las 5 fases de la Toxicocinética son:
1. Exposición
2. Absorción
3. Distribución
4.
Biotransformación 5. Eliminación
Es
importante situarse en cada uno de los casos que se traten para poder
establecer en cuál y en cuántas fases de la toxicocinética se puede actuar o
incidir, considerando las características del producto tóxico del que se trate,
así como lavía y el tiempo de exposición.
El
coctel toxicológico (glucosa, oxígeno, naloxona, tiamina) puede utilizarse en
pacientes con déficit neurológico de causa desconocida para el apoyo
diagnóstico y terapéutico.
MEDIDAS PARA EVITAR LA ABSORCIÓN DEL
TÓXICO
Las
medidas o técnicas de descontaminación existentes son:
- Lavado ocular
- Lavado de piel y/o anexos
- Barrido de piel en presentaciones del toxico en polvo.
Descontaminación
gastrointestinal (inducción del vómito, lavado gástrico, administración de
carbón activado, irrigación intestinal total). (Fig. 4 a, b, c, d)
Estas
medidas de descontaminación existentes, al ser tiempo-dependientes, pueden y
deben abordarse y realizarse por el personal de atención prehospitalaria
(técnicos en urgencias médicas, paramédicos, bomberos) con éxito, incidiendo
positivamente en el pronóstico del paciente.
El
personal de atención prehospitalaria (técnicos en urgencias médicas,
paramédicos, bomberos) y el personal hospitalario deben estar familiarizados
con todos los procedimientos de descontaminación existentes; siempre contando
con el equipo de protección personal, según sea el caso. (Fig. 3)
El
jarabe de ipecacuana es un medicamento que se utilizaba para evitar la
absorción del tóxico ingerido (descontaminación digestiva); produce vómito en
más del 90% de las personas que lo consumen, ya que contiene alcaloides
naturales (cefalina y emetina) ejerciendo efectos gastrointestinales locales y
efectos a nivel del sistema nervioso central.
La
eficacia del jarabe de ipecacuana para evitar la absorción del producto tóxico
es muy variable e impredecible, y es dependiente del tiempo ya que disminuye su
eficacia después de 30 a 90 minutos.
El uso
del jarabe de ipecacuana se asocia a efectos adversos graves (somnolencia,
letargia, broncoespasmo, bradicardia, vómitos incoercibles por más de una hora,
broncoaspiración).
El
jarabe de ipecacuana NO es un medicamento que en la actualidad deba de ser
utilizado en el ambiente extrahospitalario ni hospitalario como una medida para
evitar la absorción, ya que existen otros métodos más efectivos y con menos
efectos adversos.
Sigue
siendo discutido el uso del lavado gástrico como una medida única de
descontaminación gástrica. Los resultados de remoción del toxico son muy
variables y dependientes de dos factores importantes: toxicodinamia del tóxico
ingerido y el tiempo de la realización del procedimiento.
El
mayor beneficio del lavado gástrico como técnica de descontaminación se obtiene
si se realiza dentro de los primeros 60 minutos de ingerido el tóxico.
El
beneficio del lavado gástrico después de la primera hora no debe de ser
excluido; sobre todo en tóxicos que retarden su absorción (retardo en el
vaciamiento gástrico, que formen bezoares y que contengan capa entérica).
Previo
a la realización del lavado gástrico, se debe explicar al paciente la técnica,
beneficios y complicaciones del procedimiento; y siempre debe obtenerse
consentimiento informado.
En
pacientes con deterioro del estado de alerta, ausencia del reflejo nauseoso o
de deglución, SIEMPRE debe protegerse la vía aérea con intubación orotraqueal o
nasotraqueal, antes del procedimiento.
La
técnica del lavado gástrico debe ser en decúbito lateral izquierdo, en
inclinación de la cabeza a 20⁰ o posición de Trendelemburg. (Fig. 5)
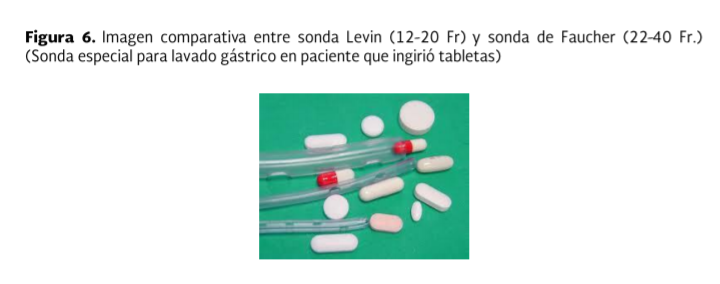
El
diámetro de la sonda orogástrica en adultos debe ser de 36 a 40 French; y de 20
a 24 French en el paciente pediátrico (sonda faucher). Esto permitirá la
remoción del tóxico de manera más eficiente. (Fig. 6)
En el
paciente adulto se recomienda la utilización de agua o solución salina,
preferentemente a una temperatura de 38 °C, con bolos de 200-300 ml; extrayendo
lo más cercano a la cantidad ingresada y hasta que el lavado sea negativo.
En el
paciente pediátrico se recomienda la utilización de solución salina, no agua
(por riesgo de hiponatremia) con bolos de 10ml/kg, a 38 °C, preferentemente;
extrayendo lo más cercano a la cantidad ingresada y hasta que el lavado sea
negativo.
Un
lavado gástrico negativo no descarta la posibilidad de una ingesta tóxica grave
o en altas cantidades.
Las contraindicaciones del lavado gástrico son:
- No contar con el nivel de capacitación o entrenamiento para la realización del procedimiento
- Pérdida del reflejo de protección de la vía aérea por deterioro neurológico o presencia de crisis convulsivas (contraindicación relativa, se puede realizar el lavado gástrico previa intubación selectiva)
- Tóxicos que incrementen el riesgo y severidad de aspiración bronquial (hidrocarburos)
- Tóxicos que, con el lavado gástrico, incrementen la gravedad de la intoxicación (jabones y detergentes, fosfuros: zinc, aluminio)
- Productos corrosivos (ácidos, álcalis). Pacientes con riesgo elevado de perforación y/o hemorragia
Las principales complicaciones del lavado
gástrico son:
- Hipoxia
- Neumonía por aspiración
- Neumonitis
- Laringoespasmo
- Arritmia cardiaca
- Perforación del esófago
- Hemorragia en vías aéreas superiores
- Desequilibrio hidroelectrolítico
El lavado gástrico puede ser recomendado para su realización en el ámbito prehospitalario, siempre y cuando se cumpla con los siguientes criterios o estándares:
- Si el paciente acepta haber ingerido medicamentos que se consideran de alta toxicidad (ej. fármacos cardiovasculares, anticonvulsivantes, etc.)
- Si el tiempo de la ingesta está dentro de los primeros 60 minutos
- Si no existe ninguna de las contraindicaciones antes descritas
- Si el tiempo de traslado será prolongado Si existe autorización por parte de su director médico
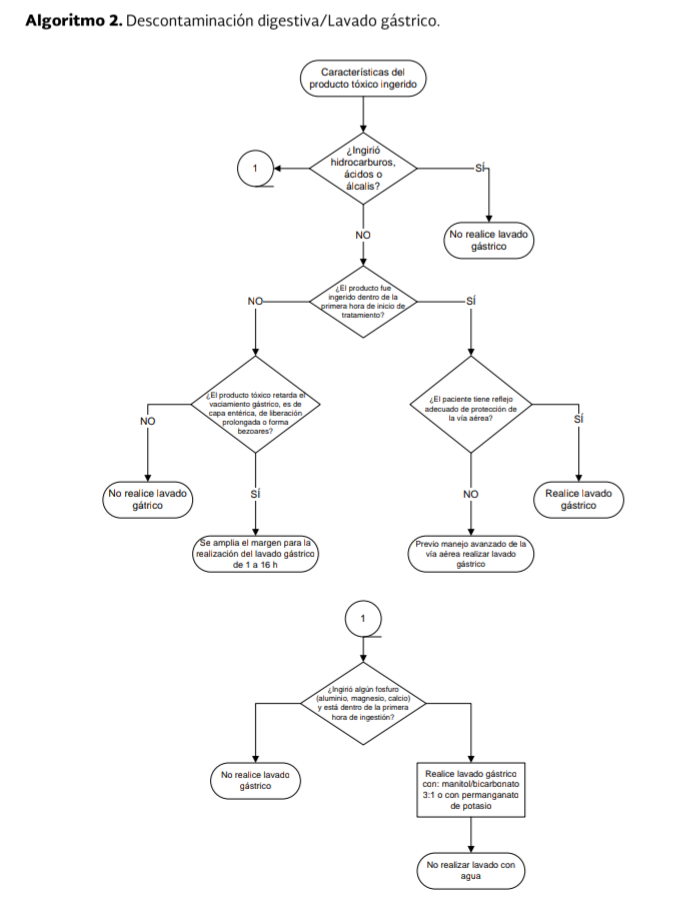
La ruta
en la toma de decisiones para la realización del lavado gástrico se ejemplifica
en el Algoritmo 2.
El
carbón activado, al entrar en contacto con el aparato gastrointestinal, tiene
la función de adsorber el tóxico y disminuir la extensión de la absorción del
tóxico; con esto reduce o previene la toxicidad sistémica.
La
administración de carbón activado es más eficaz si se administra dentro de la
primera hora de la ingestión del tóxico.
El
beneficio de la administración de carbón activado después de la primera hora no
debe de ser excluido, sobre todo en tóxicos que prolonguen su absorción por
retardo en el vaciamiento gástrico, que formen bezoares y que contengan capa
entérica.
La
administración de carbón activado puede ser por vía oral, por sonda
nasogástrica u orogástrica, dependiendo de las condiciones y el estado clínico
del paciente.
Existen
presentaciones de carbón activado ya prefabricadas, con o sin catártico, para
facilitar su uso en el ambiente prehospitalario. (Figura 7b)
Una
alternativa para el personal de atención prehospitalaria (técnicos en urgencias
médicas[TUMS], paramédicos, bomberos) en pacientes pediátricos y
neurológicamente íntegros es diluir el carbón activado en jugo de naranja,
leche con chocolate y refresco de cola, con el fin de ser más fácilmente
aceptado por el paciente.
El
carbón activado reduce significativamente la absorción de algunos tóxicos
cuando es administrado al poco tiempo de haber ingerido la droga o el producto
tóxico; por tal motivo, es fundamental que el personal de atención
prehospitalaria (TUMS, paramédicos, bomberos) se encuentren familiarizados con
el procedimiento, y que cuenten con una adecuada Dirección Médica para poder
realizar esta intervención.
Dosis del carbón activado, en dosis única, que se recomienda:
- Niños <1 año: 10 a 25 g (0.5-1.0g/kg)
- Niños de 1 a 12 años: 25-50g (0.5-1.0 g/kg)
- Adolescentes y adultos: 25-100g (0.5-1g/kg).
Dosis
máxima 100g
Posterior
a la administración de carbón activado deberá cerrarse la sonda orogástrica
para evitar la extracción del mismo.
El
carbón activado no tiene efectos benéficos en intoxicaciones por alcoholes,
hidrocarburos, cáusticos, ni en moléculas pequeñas como litio, potasio y
hierro.
Pacientes
obnubilados, con colapso hemodinámico o con crisis convulsivas (o con riesgo
potencial a cualquiera de estos por el tipo de tóxico ingerido) deberán tener
una vía aérea protegida con intubación orotraqueal antes de la administración
del carbón activado, para evitar broncoaspiración.
Los efectos adversos descritos del carbón activado, están relacionados con:
- Constipación
- Náuseas y vómito (sobre todo cuando se asocia con catárticos)
- Lesión pulmonar aguda por broncoaspiración (neumonitis química) Abrasión corneal al contacto ocular
- Deshidratación, desequilibrios hidroelectrolíticos (sobre todo cuando se asocia a catárticos)
Las contraindicaciones para el uso del carbón activado son:
- No contar con el nivel de capacitación o entrenamiento para la realización del procedimiento
- Disminución de la peristalsis, presencia de íleo de cualquier causa y/u obstrucción intestinal
- Compromiso o potencial compromiso de la vía aérea
- Hemorragia gastrointestinal
- Perforación gastrointestinal o riesgo potencial
- Cuando el carbón activado puede obscurecer la visualización de algún procedimiento endoscópico posterior
La administración del carbón activado en el ámbito prehospitalario debe de considerarse si:
1. El
paciente acepta haber ingerido medicamentos que se consideran de alta toxicidad
(fármacos cardiovasculares, anticonvulsivantes, etc.)
2. Los
signos y/o síntomas son compatibles con una intoxicación grave
3. El
tiempo de la ingesta está dentro de los primeros 120 minutos
4. El
producto tóxico es absorbible por el carbón activado
5. No
existen contraindicaciones para la administración del mismo
6. El
tiempo de traslado será prolongado 7. Cuenta con el nivel de capacitación y
adiestramiento
para la realización del procedimiento
8.
Existe autorización por parte de su Director Médico
Las
presentaciones de carbón activado en tabletas o cápsulas son inefectivas para
el manejo del paciente intoxicado, ya que tienen menor capacidad de adsorción
que el dispersable en agua. (Fig. 7 a, b, c)
La
irrigación intestinal total es una medida de descontaminación gastrointestinal
que consiste en la administración de grandes cantidades de una solución
osmóticamente equilibrada (polietilenglicol), cuya función es barrer
físicamente el tóxico hasta su eliminación completa por vía rectal impidiendo
su absorción.
La
irrigación intestinal total NO debe realizarse de manera rutinaria en todo
paciente intoxicado o con envenenamiento.
Existen
reportes de beneficios de la irrigación intestinal total en sustancias
potencialmente tóxicas y grandes cantidades de éstas; medicamentos de
liberación prolongada o con revestimiento entérico, en grandes cantidades de
hierro, en transportadores de drogas ilícitas ("body packers, body
stuffers").
Técnica
para la irrigación intestinal total. Cuadro 1
El régimen de dosificación para la administración de polietilenglicol en irrigación intestinal total recomendado es:
- Niños de 9 meses a 6 años: 500 ml/h
- Niños de 6 a 12 años: 1000 ml/h
- Adolescentes y adultos: 1500 ml/h
Esto debe continuar hasta que el efluente rectal sea claro.
Las contraindicaciones de la irrigación intestinal total son:
- Perforación intestinal
- Oclusión intestinal
- Hemorragia gastrointestinal clínicamente
- evidente
- ileo
- Compromiso de la vía respiratoria Inestabilidad hemodinámica
- Vómito incontrolable intratable
En
ingestiones de medicamentos que disminuyan el vaciamiento gástrico como
salicilatos, opioides, anticolinérgicos, puede ser inapropiada la realización
de la irrigación intestinal total.
Las complicaciones de la irrigación intestinal
total son: náusea, vómito, dolor y/o distensión abdominal y, la más
grave, broncoaspiración.
La
administración de metoclopramida (procinético y antiemético) previo a la
realización de la irrigación intestinal total puede ayudar a disminuir los efectos
adversos del procedimiento.
MEDIDAS QUE FAVORECEN LA ELIMINACIÓN
DEL TOXICO
Las técnicas existentes de eliminación del tóxico en el organismo se dividen en dos grandes grupos:
Técnicas de eliminación corpórea: Dosis
múltiples de carbón activado, diuresis forzada, alcalinización y acidificación
de la orina.
Técnicas de eliminación extracorpórea:
Diálisis peritoneal, hemodiálisis, hemofiltración, hemoperfusión, plasmaferesis, exanguinotransfusión
La
uresis forzada (administración de soluciones cristaloides acompañada de
diuréticos de asa) como una medida de eliminación corpórea, en algún tiempo fue
recomendada para eliminar productos de excreción renal como litio,
ciclofosfamida, etilenglicol, y salicilatos, entre otros. Sin embargo, al no
ser comprobada la eficacia de esta técnica y por los frecuentes eventos
adversos secundarios (sobrecarga hídrica, edema pulmonar, hipernatremia,
hipokalemia) ha quedado en desuso este procedimiento.
El
carbón activado en dosis múltiples consiste en la administración repetida (más
de dos dosis) del carbón vegetal activado por vía oral o vía sonda nasogástrica
para favorecer la eliminación del tóxico absorbido.
Todo
tóxico que tenga circulación entero-hepática, entero-entérica o
entero-gástrica, aun cuando haya sido administrado por vía no digestiva
(intravenosa, intramuscular, subcutánea) se verá favorecido con esta medida de
eliminación con dosis múltiples de carbón activado.
La
función del carbón activado en dosis múltiples es interrumpir la circulación
entero-entérica, entero hepática y entero-gástrica del producto tóxico una vez
que éste se ha absorbido. Además, permite adsorber el producto tóxico residual
(o aun no absorbido) en el intestino.
En los
tóxicos que sufren circulación entero-hepática, con una vida media de
eliminación prolongada, con un volumen de distribución bajo (<1 L/kg), y con
una baja unión a proteínas se ha observado que tienen mejores resultados
clínicos con las dosis múltiples de carbón activado.
Los
tóxicos con mayores beneficios en el uso del carbón activado en dosis múltiples
son: carbamazepina, dapsona, fenobarbital, salicilatos, quinina y teofilina.
La
dosis recomendada del carbón activado en dosis múltiples es 0.5-1g/kg, cada 2-4
horas, con o sin la administración de catártico (manitol, sorbitol o sulfato de
Mg calcinado en polvo), según las condiciones del paciente.
Antes de la administración de la siguiente dosis de carbón activado se debe verificar SIEMPRE:
- Presencia de peristalsis
- Presencia de vómitos
- Estado de hidratación del paciente (para decidir dilución de la próxima dosis con catártico o no)
- Medición de perímetros abdominales
- Verificar si el paciente ya se encuentra evacuando el carbón activado (generalmente se logra después de la segunda dosis)
La
cantidad de dosis administradas de carbón activado, serán proporcionales a la
respuesta del paciente, según el monitoreo toxicológico (ej. mediciones
repetitivas de niveles séricos cuantitativos del toxico). Si existe
imposibilidad técnica de monitoreo toxicológico se recomiendan seis dosis
totales.
Los
efectos adversos más frecuentes del carbón activado en dosis múltiples pueden
ser: íleo, obstrucción intestinal y aspiración pulmonar con lesión pulmonar
aguda.
Pacientes
que ingirieron un tóxico que cause náuseas y vómito, y que serán sometidos a la
administración de carbón activado (particularmente en combinación con sorbitol
o manitol), pueden verse favorecidos con dosis previas de antieméticos
intravenosos.
No
existen indicaciones absolutas para la coadministración de catárticos con el
carbón activado en dosis múltiples; sin embargo, se ha observado disminución en
sus efectos adversos (íleo, obstrucción intestinal) al favorecer el vaciamiento
gástrico.
En
dosis múltiples de carbón activado se recomienda diluir la primera dosis con
catártico, y el resto de las diluciones con agua (si tiene diarrea, vómito o
desequilibrio hidroelectrolítico) o catártico (si está constipado, distendido)
según sean las condiciones del paciente.
Los
catárticos más utilizados en nuestro medio son Sulfato de magnesio calcinado en
polvo, sorbitol y manitol al 20%. (Fig. 8)
Las dosis recomendadas de los catárticos
son:
1.
Sorbitol: 1-2ml/kg al 70% en adultos, y 4.3 ml/kg al 35% en niños
2.
Sulfato de magnesio calcinado en polvo por vía oral o sonda nasogástrica: 1
g/kg diluido. en 50-100 ml de agua, cada 12 h.
Las
dosis recomendadas del catártico manitol son: Manitol al 20% como diluyente del
carbón activado 3-5 ml/kg.
Los
efectos adversos reportados con el uso de catárticos son anormalidades hidroelectrolíticas
(deshidratación, hipermagnesemia, hipokalemia, hipernatremia) y ácido base
(acidosis metabólica). sobre todo en niños yadultos mayores.
Las
contraindicaciones absolutas del uso de catártico son hipotensión, depleción de
volumen y anormalidades electrolíticas significativas; insuficiencia renal y
trastornos del ritmo cardiaco como bloqueos de rama del sistema de conducción
(en estos últimos para preparados con magnesio).
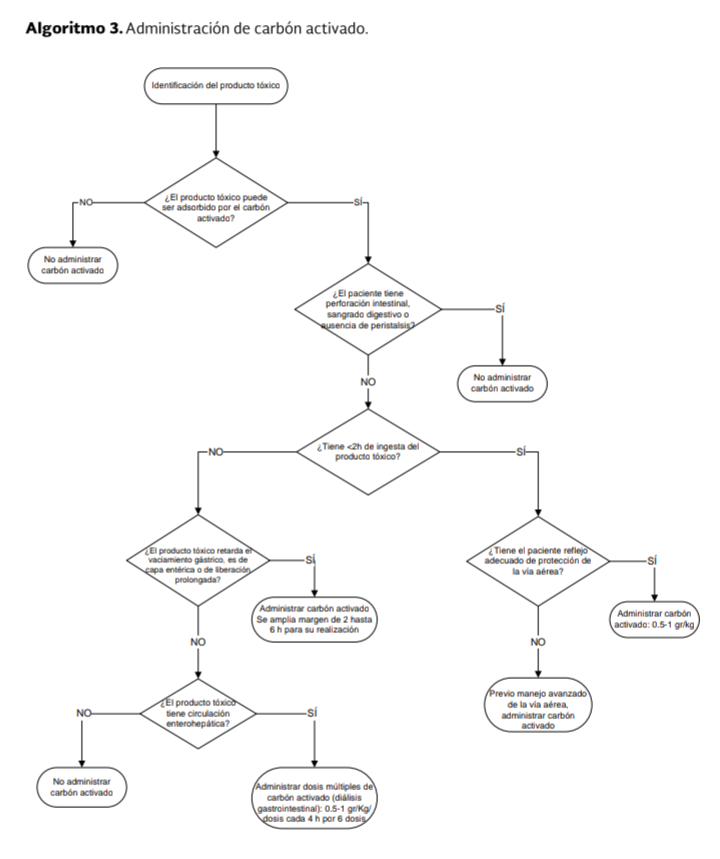
La ruta
de toma de decisiones para la administración del carbón activado, se
ejemplifica en el Algoritmo 3.
La
alcalinización urinaria es una medida terapéutica que permite incrementar o
favorecer la eliminación de algunos tóxicos, tales como cloropropamida,
fenobarbital, metrotexate y salicilatos.
La
alcalinación urinaria consiste en manipular el pH urinario (meta 7.5-8.5)
administrando dosis repetidas de bicarbonato de sodio IV, con el fin de
funcionar como trampa iónca y favorecer la eliminación del tóxico.
Cada
aumento del pH >1.0 incrementará 10 veces la eliminación urinaria del
tóxico.
Cuadro
2 Técnica alcalinización urinaria
Las
contraindicaciones absolutas de la alcalinización urinaria son insuficiencia
renal aguda o crónica, y la relativa falla cardiaca preexistente.
Las
complicaciones más comunes de la alcalinización de la orina son alcalosis
metabólica, hipokalemia y, en raras ocasiones, hipocalcemia; por ello se
requiere control estricto de electrolitos séricos y gasometrías seriadas
durante el procedimiento.
La acidificación urinaria (administración de cloruro de amonio o ácido ascórbico) es una técnica que se utilizaba para la eliminación corpórea de anfetaminas, amantadina, fenciclidina. Actualmente está en desuso debido a su escasa capacidad de eliminación y sus efectos adversos graves como la acidosis metabólica.
Las técnicas de eliminación extracopórea que existen para favorecer la eliminación de un tóxico son:
- Diálisis peritoneal
- Hemodiálisis
- Hemofiltración
- Hemoperfusión
- Exanguinotransfusión
- Plasmaferesis
La
capacidad de depuración de cada uno de estos procedimientos depende de la
cinética y de las características físico-químicas del producto tóxico.
Las principales indicaciones al someter a
un paciente a un procedimiento de eliminación extracorpórea son:
- Dosis tóxica muy alta y/o altas concentraciones plasmáticas
- Severidad clínica y complicaciones de la intoxicación
- Que el procedimiento depure o remueva más del 30% del tóxico
La
hemodiálisis se basa en la eliminación de solutos a través de una membrana
semipermeable.
El tóxico o xenobiótico debe cumplir con estas características para ser eliminable con esta técnica:
- Peso molecular <50,000 daltons Volumen de distribución <1Lt/kg
- Baja unión a proteínas
- Importante eliminación renal
La
diálisis peritoneal consiste la inserción de un cateter en la cavidad
peritoneal para, posteriormente, infundir una solución dializable osmóticamente
activa; así, el tóxico o xenobiótico difunde desde los capiplares hasta esta
solución. Tiene la desventaja de presentar una capacidad de depuración de
tóxicos mucho menor a la hemodiálisis.
La
hemofiltración se basa en el principio de convección, en el que las fuerzas
convectivas arrastran el disolvente eliminando agua y solutos. La ventaja, en
comparación con la hemodiálisis, es que puede utilizarse en pacientes
inestables y que puede filtrar moléculas o tóxicos >50,000 daltons.
En la
hemoperfusión la sangre pasa a través de una columna de carbón activado o de
resina en donde se adsorbe el veneno.
La
ventaja, en comparación con la hemodiálisis, es que puede filtrar tóxicos o
xenobióticos de pequeño y de gran tamaño (incluso los altamente unidos a
proteínas).
La
desventaja son sus complicaciones: hipocalcemia, hipoglucemia, leucopenia,
trombocitopenia).
La
exanguinotransfusión se basa en el intercambio de sangre mililitro por
mililitro. Su capacidad de depuración es menor que en otras técnicas; sin
embargo, es capaz de eliminar tóxicos unidos a los eritrocitos y no requiere
sistemas tan
complejos,
como en otras técnicas de eliminación intoxicaciones que producen hemolisis como
cromo, dapsona y arsina; asimismo, en pacientes neonatos con intoxicación por
teofilina o salicilatos.
La
plasmaferesis separa el plasma y sus solutos d la sangre sustituyéndolos por
albúmina o plasma fresco congelado en una o varias sesiones. Tiene la capacidad
de filtrar tóxicos o xenobióticos de gran peso molecular (>3,000,000
daltons) tales como dextrano y rituximab.
Sin embargo,
tóxicos más pequeños son más fácilmente eliminables con otras técnicas; es
menos accesible que la hemodiálisis y tiene más efectos adversos.
Las complicaciones más comunes de las técnicas de eliminación extracorpórea son:
- Hemorragias, hematomas
- Hipotensión arterial
- Desequilibrio metabólico
- Embolismo aéreo
- Hipocalcemia, trombocitopenia y leucopenia (hemoperfusión)






















No hay comentarios.:
Publicar un comentario