ENFERMEDAD TROMBOEMBOLICA VENOSA
El
término trombosis se refiere a la formación de una masa anormal dentro del
sistema vascular a partir de los componentes sanguíneos en un animal vivo. El
proceso de trombosis involucra diversos factores que predisponen a un individuo
a sufrir de una oclusión trombótica que
fueron descritos por Virchow desde el siglo XIX y que se conocen hasta la
fecha como “Tríada de Virchow” que
implica: lesión endotelial, estasis o alteración del flujo sanguíneo y un
estado hipercoagulable de la sangre.
La
enfermedad tromboembólica venosa (ETV) es la principal causa de morbilidad y
mortalidad en personas hospitalizadas.Comprende la trombosis venosa profunda
(TVP) y la tromboembolia pulmonar (TEP). La TEP es la tercera causa más común
de muerte por enfermedad vascular, después de la enfermedad arterial coronaria
y del accidente cerebrovascular. También es una causa prevenible de muerte
hospitalaria y una de las principales causas de muerte materna.
Además
de este impacto en la morbilidad y mortalidad, la ETE genera una carga
económica considerable. Así la ETV es uno de los mayores problemas de salud
pública en países desarrollados.
Los
factores de riesgo más importantes para ETV son hospitalización por cirugía o
enfermedades agudas, cáncer activo, enfermedades neurológicas con paresia en
extremidades inferiores, confinamiento en asilo de ancianos, traumatismos o
fracturas, trombosis venosa superficial; en mujeres en edad reproductiva el
riesgo de trombosis es más frecuente después de una cesárea que de un parto
vaginal, además del uso de anticonceptivos orales y terapia hormonal.
Aunque
la profilaxis secundaria es efectiva en prevenir recurrencia, la duración del
tratamiento de la etapa aguda no afecta el grado de recurrencia después de los
3 meses iniciales de anticoagulación profiláctica, lo que sugiere que la ETV es
una enfermedad crónica recurrente.
El
tratamiento principal del paciente con ETV es la anticoagulación, con lo cual
se previenen las complicaciones agudas como la TEP o de largo plazo (síndrome
postrombótico), por mencionar las más relevantes. Las opciones farmacológicas
incluyen el uso de heparinas (convencional o de bajo peso molecular), los
antagonistas de vitamina K y recientemente los anticoagulantes orales de acción
directa como el ribaroxabán, dabigatrán, apixabán y edoxaban, los cuales se han
posicionado como medicamentos con menos efectos secundarios y monitoreo.
La
mujer en edad fértil está expuesta a factores de riesgo para trombosis durante
el embarazo de 4 a 5 veces, el cual se incrementa significativamente en las
primeras 6 semanas posparto; el segundo factor de riesgo relevante está
asociado al uso de anticonceptivos, con una asociación directa entre dosis
mayores de 30 µg de estrógenos. Ante este contexto es pertinente dedicar un apartado
especial para el diagnóstico y manejo de la ETV durante el embarazo.
La ETV
está ubicada en el tercer lugar como causa de muerte cardiovascular, después de
la enfermedad coronaria e isquemia cerebral. Es un trastorno multifactorial (96%
de las personas que tienen por lo menos un factor de riesgo, con una incidencia
anual de 1-2 eventos por 1,000 personas/año, más frecuente en hombres y con una
clara asociación con la edad, con incremento de la incidencia de 1 caso por 100
personas/año en mayores de 55 años.
La ETV
tiene una incidencia de TVP y de TEP de 45 a 117 y de 29 a 78 por 100,000
personas por año respectivamente, la incidencia anual ajustada por edad es
mayor para hombres (130 por 100,000) que para mujeres (110 por 100,000), así
como mayor en mujeres en edad reproductiva de 16 a 44 años, comparado con
hombres de misma edad.
Entre
los factores predisponentes se encuentran la edad, índice de masa corporal,
historia familiar de trombofilia, antecedentes familiares o personales de TVP,
embarazo, cáncer entre otros.
La
trombosis es responsable de aproximadamente una cuarta parte de las muertes a
nivel mundial. La enfermedad
tromboembólica venosa (ETV) es la principal causa de muerte asociada a hospitalización
y de discapacidad en países de bajos, medianos y alto ingresos, por lo que
representa un reto a todos los sistemas de salud. Aunque una proporción
importante de los eventos trombóticos son potencialmente prevenibles, estudios
revelan un uso reducido de la tromboprofilaxis en pacientes con riesgo alto y
moderado de trombosis.
Ante
esta situación la sociedad internacional de trombosis y hemostasis (ISTH, por
sus siglas en inglés) declaró a partir del 2014 el día 13 de octubre (fecha de
nacimiento de Virchow) como el día mundial de la trombosis, como una manera de
sensibilizar a la población acerca de la importancia y consecuencias de la
trombosis.
El
diagnóstico preciso de la TVP es importante para prevenir las complicaciones
agudas potencialmente fatales de embolia pulmonar y las complicaciones a largo
plazo como el síndrome postrombótico y la hipertesión pulmonar. Otro de los
aspectos relevantes acerca del diagnóstico adecuado de la ETV es evitar una
terapia anticoagulante injustificada, que implica un alto riesgo de hemorragias
en pacientes mal diagnosticados con esta condición.
La
guía separa algunos aspectos del diagnóstico y manejo de TVP y TEP por las
implicaciones de morbimortalidad asociadas:
1) El
riesgo de muerte temprana (primer mes) debido a un primer evento de ETV
recurrente, es mucho mayor si se presenta como una TEP, lo que justifica una terapia inicial más agresiva que para una TVP.
2) Los
episodios recurrentes de ETV del tipo TEP son tres veces más frecuentes después
de una TEP que de una TVP, un aproximado de 60% o 20% después de una TEP o una
TVP respectivamente.
La
segunda innovación a la presente guía reconoce el incremento de riesgo de
trombosis en la mujer de hasta 21 veces en las dos semanas pos-parto y de 4 a 5
durante el embarazo, por lo que hace referencia al diagnóstico y manejo de ETV
durante el embarazo y puerperio, así como a los eventos trombóticos asociados a
diversos anticonceptivos.
Los
factores de riesgo para un primer evento de Enfermedad Tromboembólica Venosa
(ETV) pueden ser genéticos, adquiridos o ambientales. Cuadro 1.
Se
recomienda que a la persona que presente un primer evento de ETV se investiguen
los factores de riesgo para verificar si son genéticos, adquiridos o
ambientales. Consignar en el expediente.
Se recomienda
catalogar los factores de riesgo de la ETV en provocados y no provocados.Ver
cuadro 2.
En
cambio, los factores de tromboembolismo arterial, enfermedad cardiaca coronaria
y la enfermedad arterial periférica, ocurren principalmente asociados a
factores de riesgo modificables tales como hipertensión arterial,
hiperlipidemia, diabetes y tabaquismo.
Todos
los pacientes hospitalizados requieren de una estratificación de riesgo para
presentar ETV. El método de estratificación debe ser simple, eficiente y costo
efectivo.
Los
factores de riesgo clásicos incluyen cáncer, cirugía, inmovilización
prolongada, fracturas, puerperio, parálisis, uso de anticonceptivos orales,
síndrome de anticuerpo antifosfolípido y otras condiciones trombofílicas adquiridas
o hereditarias. La mayoría de los pacientes hospitalizados tienen cuando menos
una condición de riesgo para ETV y las decisiones respecto al riesgo de ETV
deben incluir consideraciones sobre riesgos trombóticos actuales y futuros.
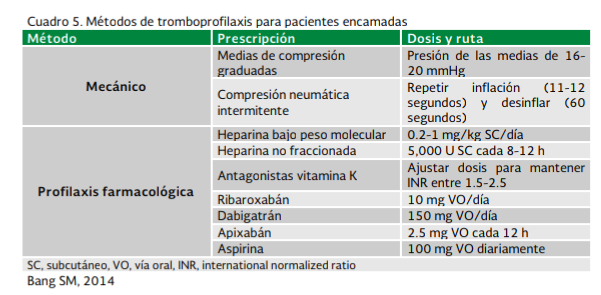
La tromboprofilaxis no farmacológica incluye ambulación temprana, ya que incrementa el flujo sanguíneo venoso y reduce la estasis venosa. La ambulación temprana es una medida simple que se puede aplicar en la práctica. La profilaxis mecánica que incluye medias de compresión graduada y la compresión mecánica intermitente, para reducir estasis venosa y el estancamiento de sangre ya que promueven el flujo sanguíneo venoso por compresión externa.
Se
recomienda reconocer los factores de riesgo para ETV y estratificarlo, sobre
todo en el paciente quirúrgico y emplear un esquema de tromboprofilaxis ya sea
mecánico,farmacológico o combinado. Así también clasificar el riesgo de acuerdo
al grado de probabilidad de trombosis en riesgo alto, intermedio o bajo, de
acuerdo a la razón de momios (OR). Cuadros 2, 3, 4 y 5
Al
paciente sometido a cirugía ortopédica mayor se le recomienda tromboprofilaxis
farmacológica y si tiene riesgo de hemorragia profilaxis mecánica. A todo
paciente se le indicará deambulación temprana pos operatorio.Cuadro 6
Los
viajeros con alto riesgo de presentar trombosis asociada a viajes, si este es
>3 h, es importante que utilicen medias de compresión por debajo de las
rodillas. En este grupo también se considerará tromboprofilaxis farmacológica.
Los viajes
en avión >4 h de duración representan un factor de riesgo moderado y
transitorio para ETV, por lo que se considera una trombosis asociada a viaje
aéreo, si se presenta en las 4 semanas posterior al viaje y sin la presencia de
otro factor de riesgo para trombosis. Se dará terapia anticoagulante por 3
meses y tromboprofilaxis para futuros viajes en este contexto de personas.
Se
recomienda terapia anticoagulante por 3 meses y tromboprofilaxis para futuros
viajes en persona que presente una trombosis asociada a viaje prolongado (>4
h),que se presente en las 4 semanas siguientes a este y sin la presencia de
otro factor de riesgo para trombosis.
La
Trombosis Venosa Profunda (TVP) presenta edema inexplicable de una extremidad,
con dolor (referido como calambre en pantorrilla o muslo), aumento de calor
local, eritema o cianosis y/o dilatación de venas superficiales, así como
presencia de factor(es) de riesgo (s) para trombosis (en 75 a 96% de los casos
presentan por lo menos un factor de riesgo), iguales para Tromboembolia
Pulmonar (EP) y TVP.
Sospechar
TVP en la persona que presenta en una extremidad edema inexplicable, con dolor,
aumento de calor local, cambios de coloración (eritema o cianosis), dilatación
de venas superficiales y signos clínicos de Homans, Lisker y/o Bancroft o
Moses, positivos.
El 90%
de los casos de TVP se presenta en piernas(principalmente pantorrilla, con
extensión del trombo hacia venas proximales, por arriba de rodilla y muslo), 5%
en brazos (o venas más centrales) y 5% en sitios inusuales (venas cerebral o
visceral). El 50% no presenta datos clínicos y al menos 40% de los casos TVP
proximal tendrán una Tromboembolia Pulmonar (TEP) que puede ser asintomática.
Aproximadamente 2/3 de los casos de ETV se presentan con sospecha de TVP y un
1/3 con probable TEP, con o sin síntomas de TVP.
Se
recomienda la búsqueda intencionada de TVP en miembros inferiores,
principalmente pantorrilla y vigilancia estrecha de trayectos venosos
proximales para detectar oportunamente una probable tromboembolia pulmonar.
Se
recomienda utilizar el modelo de probabilidad clínica de Wells para clasificar
el riesgo de TVP en bajo, intermedio o alto y evaluar (si están disponibles) en
conjunto con los resultados del Dímero D (DD) y ultrasonido (USG). Cuadro 7
Se
recomienda que en la persona con baja probabilidad clínica del modelo de Wells
(puntaje ≤0) un DD negativo de alta sensibilidad descarta la TVP, sí el DD
es positivo realizar USG dúplex a color. Si no se dispone del DD se sugiere
realizar ultrasonido dúplex en toda la pierna.
En caso
del ultrasonido dúplex, considerar como un estudioverdadero negativo si todos
los segmentos de la pierna son negativos y libres de flujo Doppler, incluyendo
la ilíaca externa, femoral común, femoral, poplítea y venas de pantorrilla.
En pacientes con probabilidad
clínica intermedia del modelo de Wells (puntaje 1 a 2) se recomienda:
- USG por compresión positivo dar tratamiento anticoagulante.
- Sí el USG sólo se realiza en venas proximales y es negativo, se repite en una semana o agregar determinación del DD.
- DD negativo, no se requieren más estudios.
- USG de toda la pierna es negativo, se descara TVP.
En el paciente con alta probabilidad
clínica de escala de Wells (≥3 puntos) se recomienda lo siguiente:
- No determinar DD.
- Con USG positivo, iniciar tratamiento anticoagulante.
- Con USG, realizado solo en venas proximales:
- Cuando es negativo realizar DD, si este es negativo suspender la anticoagulación, si es positivo repetirlo en una semana sin suspender anticoagulación;
- repetir el USG en 3 días con alta sospecha y en 7 días con baja sospecha.
- Si el USG de toda la pierna es negativo, no realizar más estudios.
El DD
es un producto de degradación de la fibrina derivado de la proteólisis mediada
por la plasmina, es un marcador indirecto de la activación de la coagulación y
fibrinólisis.
Representa
el mejor biomarcador reconocido para la evaluación inicial, ante la sospecha de
una ETV.
Los
niveles de DD se pueden elevar con la edad avanzada, infección, embarazo,
inflamación crónica, cáncer, trauma y cirugía reciente, y pueden condicionar un
resultado falso positivo, por lo que un resultado positivo aislado no establece
el diagnóstico de ETV.
Se
recomienda utilizar el DD para descartar TVP si el resultado es normal, en una
persona con riesgo bajo de trombosis, el diagnóstico de ETV improbable. Se
sugiere no considerar los niveles elevados de DD aislados (en edad avanzada,
infección, embarazo, inflamación crónica, cáncer, trauma y cirugía reciente),
para establecer el diagnóstico de ETV.
Se
recomienda medir el DD con ensayos de alta sensibilidad(ELISA, inmunoabsorción
asociado a enzimas en microplaca (ELISAs y por técnicas inmunoturbidimétricas)
de no contar con estos utilizar los de sensibilidad moderada (aglutinación de
glóbulos rojos en sangre total y ensayos semicuantitativos de aglutinación por
látex).
Se recomienda utilizar el punto de corte de DD <1000 µg/L para excluir ETV en personas con baja probabilidad clínica y <500 µg/L para casos de riesgo intermedio. Otra opción es utilizar la edad del paciente, con un punto de corte de 500 µg/L, para excluir la ETV en personas ≤50 años y en las mayores de 50 años el punto de corte es el resultado de edad del paciente multiplicado por 10 (a los 75 años=75 X 10=750 µg/L Se sugiere tomar con precaución el valor del DD en personas con comorbilidades con elevación del mismo, por lo que en estos casos se recomienda optar por el USG con compresión.
Es
importante tomar en cuenta los cortes del DD de cada laboratorio.
El
ultrasonido (USG) es una técnica no invasiva, disponible y relativamente barata
que ha reemplazado, como prueba de elección para el diagnóstico de TVP, a la
venografía con contraste. Además de que ofrece la ventaja de evaluar otras
patologías como parte del diagnóstico diferencial: quiste de Baker, hematomas,
linfadenopatias, aneurisma femoral, tromboflebitis superficial o abscesos. Es
un estudio accesible, se puede realizar con equipo de cualquier marca,
frecuencia del transductor y fecha de fabricación.
Se
recomienda el ultrasonido (USG) venoso como el estudio de imagen de elección
para el diagnóstico de TVP.
Se
recomienda realizar al ultrasonido dúplex completo (evaluando el sistema venoso
profundo del miembro inferior, desde la femoral común hasta el tobillo,
incluyendo la vena tibial posterior y peroneo de pantorrilla) para el diagnóstico
de TVP aguda. No está indicado en personas obsesas, o con heridas, vendajes o
inmovilizadas.
De no
disponer de este equipo realizar el estudio con ultrasonido modo B.
Se
recomienda la evaluación completa, por ultrasonido, del sistema venoso profundo
desde la primera vez, ya que sí es parcial (por arriba o debajo de rodilla)
puede requerir de una segunda evaluación en 5 a 7 días, dependiendo de los factores
de riesgo y sintomatología.
La
recomendación para un segundo estudio es para aquellos casos en los que el
primer ultrasonido dúplex completo es negativo
y persisten o se incrementan los síntomas, sí hubo problemas técnicos en el
primer estudio o los hallazgos fueron inconclusos.
La
evaluación del sistema venoso profundo de miembros inferiores por ultrasonido
debe de involucrar todo el miembro afectado con el equipo disponible en cada
unidad médica.
La
flebografía o venografía ascendente fue el estándar de oro para el diagnóstico
de la TVP proximal, distal y de extremidades superiores. El signo clave es un
defecto de llenado intraluminal en dos o más proyecciones, o un corte súbito de
la vena profunda; esta técnica es costosa, invasiva, puede ser dolorosa y
requiere la inyección de contraste radiográfico por lo que casi no se realiza,
a excepción de casos de difícil diagnóstico o de trombosis de extremidades
superiores, o por no contar con técnicas no invasivas como el USG y/o el DD.
La
flebografía ascendente o venografía contrastada solo se recomienda en casos de
difícil diagnóstico o trombosis de extremidades superiores, o si no se cuenta
con técnicas no invasivas como el USG y/o el DD.
La
venografía por tomografía (TC) o por resonanciamagnética nuclear (RMN) se
recomienda para valorar sitios en los que el USG es inadecuado como es en venas
pélvicas, vena cava inferior o superior, y/o vena innominada, asícomo para
diferenciar por imagen trombosis reciente de la crónica.
La
pletimosgrafia por impedancia es un estudio seguro y no invasivo, mide el
cambio de energía eléctrica entre dos electrodos colocados en la pantorrilla.
El flujo de sangre venosa normal produce un cambio en la impedancia, mientras
que un retardo en el flujo por una trombosis ocasiona un cambio más gradual de
ésta. La sensibilidad es muy baja para detectar trombos en pantorrilla y
pequeños trombos en venas proximales. Es un estudio en desuso y sin evidencia
de recomendación para el diagnóstico de TVP.
Considerar
trombosis de miembro superior (TMS), independientemente de sí hay causas
predisponentes o no.
En caso
de TMS con compresión de la vena subclavia interrogar a la persona de si
realizó movimientos repetitivos o enérgicos del brazo.
En
personas con cáncer, catéter venoso central o con cirugías de la extremidad
superior, se recomienda, vigilar datos de síndrome de salida de tórax (SST).
Las
manifestaciones clínicas de la TMS incluyen dolor, inflamación y enrojecimiento
del brazo acompañados de debilidad, parestesias, dilatación de venas
colaterales sobre el brazo, cuello o tórax.
Se
recomienda sospechar de Trombosis Miembro Superior (TMS) en la persona que
presente en un miembro superior dolor, inflamación, enrojecimiento, debilidad,
parestesias, dilatación de venas colaterales ya sea sobre el brazo, cuello o
tórax.
Realizar
dímero D, con punto de corte de 500 µg/ml. Si la probabilidad es baja y el DD
negativo se descarta la trombosis sin necesidad de USG. Vigilar por 3 meses.
Aunque
la probabilidad sea baja pero el DD está alterado realizar USG.
El DD
tiene una sensibilidad del 92-100% y una especificidad muy baja (14-60%) para
trombosis de miembros superiores debido al menor tamaño del trombo y
mayor
prevalencia de comorbilidades, sin embargo un DD negativo conserva su alto
valor predictivo negativo.
Se
recomienda utilizar la escala diagnóstica de Constans en combinación de
estudios de laboratorio y gabinete para descartar o confirmar la TMS, así como
la determinación del DD y el USG para evaluar el sistema venoso profundo de
brazo hasta la vena axilar y yugular y mediante USG a color la subclavia.
Si la
probabilidad es baja y el DD negativo se descarta la trombosis sin necesidad de
USG y se vigila por 3 meses; en caso de una baja probabilidad y DD alterado se
realiza USG.
Se
recomienda utilizar venografía, TC o RM, cuando la TVP se localiza en sitios
anatómicos inaccesibles por US.
La
venografía ascendente se recomienda para casos de difícil diagnóstico.
¿Para el diagnóstico de embolia pulmonar la combinación de escalas probabilísticas con estudios de laboratorio (dímero D) es superior que con estudios de imagen?
El
diagnóstico se sospecha con base a disnea, dolor torácico, síncope o
pre-síncope y/o hemoptisis. La hipotensión arterial y el choque, son raros,
pero su presencia tiene significancia clínica ya que indica EP central con
reserva hemodinámica muy reducida. Así también puede presentarse asintomática y
ser un hallazgo incidental de estudios de evaluación general o en autopsias. Cuadro
8
El
dolor torácico es un síntoma frecuente y por lo general esa causa de irritación
pleural por émbolo distal que causa infarto pulmonar, este dolor también puede
tener carácter de angina típico, posiblemente reflejando isquemia del ventrículo
derecho, por lo que puede ser necesario realizar diagnóstico diferencial con
infarto del miocardio.
Sospechar EP en paciente que presente dolor torácico pleurítico, hemoptisis y dato clínico de TEP manifestado por edema de una sola extremidad. Se recomienda aplicarle las escalas probabilísticas de Wells y de Ginebra. Cuadros 8, 9 y 10
Se
recomienda realizar, a todo paciente con sospecha de EP, la determinación del
DD; si el valor está en corte normal para la edad, se descarta la EP. Si está
elevado, descartar otras causas que pueden ocasionar su elevación.
Entre
los estudios de imagen se encuentran: angiografía pulmonar por tomografía
computarizada (APTC), con el sistema multi detector, tiene alta resolución
temporal y espacial, es el método de elección para valorar la vascularidad
pulmonar en paciente con sospecha de EP, con una sensibilidad de 83% y
especificidad de 96%.Gammagrafía de perfusión-ventilación pulmonar: es una prueba
diagnóstica segura y con pocas reacciones alérgicas.
Se basa
en aplicar una inyección intravenosa de partículas de macro agregados de
albumina marcados con tecnecio 99, estos bloquearan una pequeña fracción de
capilares pulmonares y así se da seguimiento a la función pulmonar.
Angiografía
pulmonar: fue el estándar de oro para el diagnóstico de exclusión de EP, sin
embargo hoy tiene poco uso al ser sustituida por el método menos invasivo de
APTC.
Angiografía
por resonancia magnética: técnica que aún está en investigación.
Ecocardiografía:
como la EP aguda puede desencadenar alteración en la función del ventrículo
derecho (VD) por sobrecarga lo que se puede detectar porecocardiografía.
No se
requiere si el paciente está hemodinámicamente estable, normotenso y sin
sospecha alta de EP; pero si cuando la sospecha de EP es alta.
Ultrasonografía
por compresión venosa de miembros inferiores, en la mayoría de los casos la EP
se desencadena a consecuencia de TEV de miembros inferiores, con esta técnica
se puede diagnosticar hasta el 70% de TVP, si esta se encuentra en la parte
proximal y existe sospecha clínica de EP, se confirma este diagnóstico, pero
como si muestra la parte distal de la TVP se requieren más estudios para
confirmar o descartar el diagnóstico de EP.
La
técnica de imagen recomendada para confirmar diagnóstico de EP es Angiografía
pulmonar por tomografía computarizada (APTC) sistema multi detector. El
gammagrama pulmonar se recomienda en personas con baja probabilidad de EP,
individuos jóvenes, en embarazadas, si existe un fuerte antecedente de alergia,
si con medios de contrastes han presentado anafilaxia en insuficiencia renal
grave y en personas con mieloma múltiple y paraproteinemia.
¿La terapia anticoagulante optima, de acuerdo a etiología y estado físico del paciente mejora la evolución?
La
terapia anticoagulante es el tratamiento primario de la ETV, con el objetivo de
prevenir la extensión del trombo, la tromboembolia
pulmonar aguda, la recurrencia y el desarrollo de complicaciones tardías como
hipertensión pulmonar y/o el síndrome pos-trombótico.
Se
recomienda la terapia anticoagulante como el tratamiento primario de la ETV,
adecuando a las consideraciones clínicas de la persona el inicio de terapia.
Se
sugiere evaluar la posibilidad de terapia ambulatoria en pacientes con TVP
manteniendo una comunicación efectiva por
parte del personal de salud hacia el paciente y/o cuidador. Cuadro 11
A la
persona con bajo riesgo para EP con vivienda en condiciones adecuadas se
recomienda dar de alta tempranamente, en los primeros 5 días de tratamiento).
Cuando
existe alta sospecha clínica de TVP aguda, y no se cuenta con los resultados de
los estudios, se recomienda iniciar
terapia anticoagulante parenteral. Si la sospecha clínica es baja no se
recomienda iniciar anticoagulación, hasta contar con los resultados.
Consideraciones para elección del régimen
inicial de anticoagulación:
TVP de
pierna o TEP sin cáncer dar terapia con Anticoagulantes Orales de Acción
Directa (AOAD)(dabigatrán, rivaroxaban, apixaban o edoxaban) en lugar de los
Antagonistas de Vitamina K (AVK) durante los primeros 3 meses.
TVP de
pierna o TEP sin cáncer que no reciben AOAD se dará terapia anticoagulante con
AVK en lugar una Heparina de Bajo Peso Molecular (HBPM).
TVP de
pierna o TEP con cáncer se sugiere terapia anticoagulante con HBPM durante los
3 primeros meses, en lugar de AVK o los AOAD. Cuadro 12
En
paciente con ETV sin cáncer iniciar y continuar en los primeros 3 meses con
alguno de los AOAD (dabigatrán, ribaroxabán, apixabán) en lugar de los AVK, si
no pueden recibir AOAD dar AVK y no HBPM.
En
paciente con ETV y cáncer dar terapia anticoagulante con HBPM durante los 3
primeros meses. Utilizar una HBPM, en lugar de la heparina no fraccionada (HNF)
ya sea intravenosa o subcutánea, considerar aspectos de costo, disponibilidad y
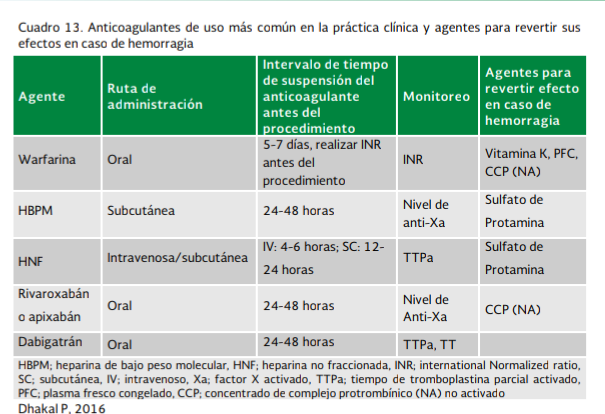
familiaridad con el tratamiento. Cuadro 12, 13, 14 y 15.
Se recomienda calcular las dosis de HBPM por
peso corporal en kg:
La
dosis de enoxaparina es de 1 mg/kg vía subcutánea (SC) C/12 h o 1.5 mg/kg C/24
h. con aplicación diaria excepto en embarazadas que la recibirán C/12 h después
de las 20 semanas de gestación (SEG).
Las
dosis mayores de 400 mg/día requieren de monitoreo farmacológico.
Se recomienda utilizar la HNF por vía
intravenosa (IV) o SC:
dosis
para vía intravenosa en bolo inicial a 80 U/kg, seguido de una infusión
continua (IC) de 18 U/kg por h.
Dosis
para uso SC inicial de 333 U/kg, después 250 U/kg.
La
duración óptima de HNF es de 5 días, considerando el inicio temprano de AVK y
la obtención de niveles terapéuticos de INR.
Se
recomienda emplear HNF en personas en espera de algún procedimiento invasivo,
antecedente de hemorragia mayor reciente, insuficiencia renal grave, peso muy
bajo u obesidad mórbida. Para terapia ambulatoria, los Anticoagulantes Orales
de Acción Directa (AOAD) son los indicados.
Indicaciones
para el inicio de la terapia anticoagulante con AVK: Persona con ETV aguda
iniciar la terapia con AVK en el día 1 o 2 del tratamiento con HBPM o HNF.
Iniciar
warfarina a la brevedad, usualmente al mismo tiempo de iniciada la heparina. No
se recomienda la dosis de “carga” de warfarina, ya que puede provocar niveles
por arriba de los niveles terapéuticos de INR, por lo que se inicia con una
dosis de 5 mg/día por la tarde. Sí la persona utiliza medicamentos que tienen
interacción con warfarina, o son de edad avanzada, o tienen falla cardiaca o
hepática usar dosis diferentes a las de 5 mg.
Persona
tratada con AVK mantendrá un rango terapéutico de International Naturalized
Ratio (INR) entre 2.0 a 3.0 (objetivo 2.5), en lugar de niveles bajos (INR <
2) o altos (INR 3.0-5.0).
La
persona en tratamiento con AVK, evitará el consumo de suplementos con vitamina
K, así como tratamientos concomitantes con antiinflamatorios no esteroideos,
incluyendo los inhibidores de la ciclooxigenasa 2 (COX-2) y ciertos
antibióticos. Estudios reportan un incremento en el riesgo de hemorragia con
cotrimazol y quinolonas, otros reportes sugieren que las cefalosporinas,
metronidazol, amoxicilina con o sin clavulanato, doxiciclina y fluconazole pueden
incrementar este riesgo.
Se
recomienda iniciar la terapia anticoagulante con AVK en el día 1 o 2 del tratamiento
con heparina (HBPM o HNF), con una dosis de 5 mg/día de warfarina por la tarde,
sin utilizar dosis de “carga” de la misma.
Utilizar
una dosis menor de 5 mg de warfarina en la persona que toma medicamentos que
tienen interacción con esta, o tienen edad avanzada, falla cardiaca o hepática.
Mantener
el rango terapéutico de International Naturalized Ratio (INR) entre 2.0 a 3.0
(objetivo 2.5), en lugar de niveles bajos (< 2) o altos (3.0-5.0). Suspender
heparina una vez documentado que el INR se encuentra en nivel terapéutico.
Recomendar a la persona que toma AVK evitar el uso de suplementos con vitamina K, tratamientos que contengan antiinflamatorios no esteroideos, como los inhibidores de la ciclooxigenasa 2 (COX-2), así también antibióticos como cotrimazol, quinolonas, cefalosporinas, metronidazol, amoxicilina con o sin clavulanato, doxiciclina y fluconazole.
Evitar
tratamientos concomitantes con antiagregantes plaquetarios, excepto en
situaciones donde el beneficio sea mayor que el riesgo de hemorragia como
personas con válvulas mecánicas, síndromes coronarios agudos, o con cirugía
reciente de bypass o stent coronario.
Dar
seguimiento a la persona anticoagulada con AVK como sigue: INR estable,
realizar monitoreo cada 12 semanas, en lugar de cada 4.
Sí el
INR está en rangos estables y presenta un solo reporte por debajo o por arriba
de los niveles terapéuticos, se continuará la misma dosis y revalorar en 1 o 2
semanas. INR está entre 4.5 y 10, sin hemorragia, no dar vitamina K.
INR
>10.0, sin hemorragia, iniciar vitamina K oral.
Con
hemorragia mayor hacer reversión rápida del efecto anticoagulante con plasma
fresco congelado (PFC), a dosis de 12-15 ml/kg de peso, una dosis y valorar
respuesta.
Concomitantemente
administrar de 5 a 10 mg vitamina Ken bolo intravenoso lento.
En
persona elegible para suspender tratamiento con el AVK se hará de forma súbita
y no con una reducción gradual de la dosis.
En
persona con síndrome antifosfolípido con tromboembolismo arterial o venoso se
recomienda terapia con AVK, manteniendo el INR en rango terapéutico entre 2.0 a
3.0.
Anticoagulantes
orales de acción directa (AOAD): estos fármacos han demostrado efectividad para
el tratamiento de ETV. Ofrecen la ventaja de administración oral, no requieren
monitoreo por laboratorio y tienen menos interacciones con otros medicamentos.
Dabigatrán
a dosis estándar tiene la misma efectividad que HBPM/warfarina en el
tratamiento a corto plazo de ETV, se tendrá precaución para pacientes mayores
por reportes de un aparente incremento en el riesgo de síndrome coronario agudo
de acuerdo a un meta análisis.
Rivaroxaban
es tan efectivo como la HBPM/warfarina en el manejo agudo y a corto plazo de
ETV, sin incremento de síndrome coronario agudo, pero con un aparente mayor
riesgo de sangrado del tubo digestivo (STD) en mayores de 75 años.
Apixaban
es igual de efectivo como la HBPM/warfarina en el manejo agudo y a corto plazo
de ETV, sin incremento desíndrome coronario agudo ni STD.
Edoxaban
es tan efectivo como la HBPM/warfarina en el manejo agudo y a corto plazo de
ETV, con menor riesgo de hemorragia.
Los
AOAD dabigatrán o edoxaban requieren de anticoagulación parenteral 5 días
previos, en contraste con rivaroxaban y apixaban que se pueden utilizar sin
necesidad de tratamiento parenteral.
Se
recomienda utilizar anticoagulantes orales de acción directa (AOAD), apixabán,
dabigatrán o ribaroxabán, de acuerdo a causa y condiciones clínicas del
paciente, en especial para anticoagulación indefinida en ETV asociada a cáncer
o no provocada y quienes tienen bajo riesgo de hemorragia.
ETV no
provocado: o idiopático, es el evento trombótico no asociado a un factor de
riesgo ambiental o adquirido. La presencia de factores no ambientales
(trombofilia, género o edad avanzada), no califican la trombosis como
provocada, pero pueden influir en el riesgo de recurrencia.
-ETV
provocado: se asocia a un factor de riesgo conocido para trombosis, ya sea
transitorio o persistente. Los factores de riesgo transitorios son los que se
resuelven posteriores al desarrollo de la ETV, como cirugía o terapia con
estrógenos y tienen un bajo riesgo de recurrencia de trombosis posterior a la
suspensión de la anticoagulación.
Los
factores de riesgo persistentes como el cáncer confieren un alto riesgo de recurrencia
posterior a la suspensión de la terapia anticoagulante.
Se
recomienda categorizar los eventos trombóticos como provocados o no provocados.
La anticoagulación se divide
en tres etapas:
Aguda o inicial:
comienza en los primeros 7 días de tratamiento se emplea terapia parenteral
durante la transición a los antagonistas de vitamina K (AVK), su objetivo es abatir la generación de trombina y
fibrina del coágulo, reduciendo los síntomas agudos de la ETV y previniendo la
extensión y embolización del trombo.
Las opciones terapéuticas en esta fase son: HNF
parenteral, HBPM SC, fondaparinux SC y/o anticoagulantes orales de acción
directa (AOAD).
Largo plazo:
período comprendido entre 7 días y 3 meses con opciones terapéuticas de AVK, HBPM
SC (personas con cáncer) y/o AOAD.
Extendida:
mayor de 3 meses sin suspensión, incluye AVK, HBPM SC (pacientes con cáncer),
AOAD, aspirina o ninguno.
Se
recomienda dividir el tratamiento en 3 etapas: aguda o inicial-primeros 7 días
de tratamiento con heparina (HNF o HBPM), en transición a un AVK, o
anticoagulantes orales de acción directa (AOAD). Largo plazo-entre 7 días y 3
meses,las opciones terapéuticas son AVK, HBPM SC (personas con cáncer) y/o
AOAD.
Extendida-mayor
de 3 meses sin suspensión, con opciones de AVK, HBPM SC (personas con cáncer),
AOAD, aspirina o ninguno.
La
duración de la terapia: de 4-6 semanas; para TEV provocada por cirugía, con
riesgo transitorio de 3% de recurrencia a los 5 años. 3 meses, cuando es
provocado por un factor de riesgo transitorio, no quirúrgico, como terapia con
estrógenos, embarazo, traumatismo en miembros inferiores, viajes > 8h, con
15% de riesgo de recurrencia a 5 años
Más de
3 meses, pero con un curso limitado de tratamiento, de 6-12 meses, en eventos
no provocados o idiopáticos y que no llenan los criterios de riesgo transitorio
o por cáncer, con un riesgo de recurrencia a 5 años de 30%.
Extendida
o indefinida, asociada a cáncer, con riesgo de 15% de recurrencia anualizada.
Se recomienda anticoagulación:
- Por 3 meses en persona con TVP proximal de pierna o TEP provocada por un factor de riesgo transitorio no quirúrgico o seguido de una cirugía.
- 3 meses en persona con TVP, no provocada, de pierna (proximal o distal aislada) o TEP, hay que evaluar el riesgo beneficio de una terapia extendida.
- Terapia indefinida en persona con un primer evento no provocado de TVP proximal de la pierna o TEP y que tengan un riesgo bajo o moderado de sangrado con revaloración periódica (anual).
- 3 meses en persona con un primer evento no provocado de TVP proximal de la pierna o TEP y con riesgo alto de hemorragia.
A la
persona que ha sido sometida a una cirugía mayor se recomienda vigilar
estrechamente, en las primeras 6 semanas post cirugía, para descartar
tempranamente ETV, continuar de igual manera, en las primeras 12 semanas y no disminuir
hasta los 12 meses pos operatorio.
Se
recomienda dar la terapia anticoagulante por 3 meses o durante la permanencia
del factor de riesgo en pacientes con ETV asociada a una comorbilidad médica
(no quirúrgica).
Se
recomienda que en personas que ameritan de una terapia anticoagulante extendida
no cambiar el tratamiento elegido durante los primeros 3 meses, en caso de
alguna modificación adecuarse a las circunstancias o preferencias del paciente.
Se recomienda elegir entre estas
opciones de tratamiento para una anticoagulación extendida (≥3 meses):
• AVK
(manteniendo INR entre 2-3).
• HBPM
• AOAD.
Se
recomienda la aspirina (100 mg/día) en la persona con riesgo de recurrencia de
ETV que no es candidata a terapia anticoagulante extendida o que desea
suspender la anticoagulación.
Se
recomienda la terapia anticoagulante en lugar de la trombolisis sistémica o
dirigida por catéter o trombectomía venosa quirúrgica en todo paciente con TVP
proximal de miembro inferior.
La
terapia trombolítica sistémica o guiada por catéter se recomienda sólo en casos
con TVP extensa de miembro inferior (iliofemoral) que con riesgo importante de
complicaciones pos-trombótica, síntomas <14 días, buen estado funcional, expectativa
de vida >1 año o con falla a la terapia inicial con anticoagulantes, además
de bajo riesgo de hemorragia.
Verificar
que la persona que fue sometida a algún procedimiento de remoción del trombo
reciba terapia anticoagulante semejante a la de los no sometidos a uno de estos
procedimientos.
Se
recomienda la deambulación temprana una vez que se obtienen niveles
terapéuticos de anticoagulación en persona con TVP aguda de miembro inferior.
Si hay dolor y/o edema grave se diferirá y se dará terapia de compresión.
En el
paciente con TVP aguda de miembro inferior no se recomienda el uso de medias de
compresión.
La
decisión del esquema de anticoagulación dependerá de las condiciones clínicas
del evento trombótico (provocado, no provocado, recurrente, superficial) y se
consideraran aspectos como: disponibilidad, costo y apego al tratamiento, y en
caso necesario acceso de los estudios correspondientes para monitoreo.
Se
recomienda vigilar la TVP distal aguda de miembro inferior (vena peronea,
tibial posterior, anterior, gastrocnemio y soleo de pantorrilla) después de la
semana del diagnóstico, para considerar opciones terapéuticas.
Tratamiento de TVP distal dependerá de la
gravedad de los síntomas:
Sin
síntomas graves y sin factores de riesgo para extensión del trombo como son:
Dímero D (DD) positivo, trombo extenso (>5 cm de longitud, que involucre
múltiples venas o >7 mm de diámetro máximo), trombosis cercana a las venas
proximales, trombosis no provocada, cáncer activo,antecedente de ETV, persona
hospitalizada. Solo se dará vigilancia por estudios como imágenes seriadas por
USG Doppler de las venas profundas semanal o antes por 2 semanas.
Se recomienda tratamiento anticoagulante de
la misma manera que una TVP proximal cuando:
- El paciente tiene síntomas graves o factores de riesgo para extensión.
- Sí hay extensión del trombo hacia las venas proximales o extensión dentro de venas distales, corroborado por USG Doppler.
- Si no hay contraindicación para anticoagulación se vigilará con USG dúplex en una semana.
En
pacientes sin síntomas graves y sin factores de riesgo para extensión del
trombo se recomienda vigilancia con imágenes seriadas por USG Doppler de las
venas profundas semanal o antes por 2 semanas.
En el
paciente con TVP distal aislada de miembro inferior, provocada por cirugía o por
un factor de riesgo no quirúrgico, transitorio se recomienda terapia
anticoagulante por 3 meses
Se
recomienda una anticoagulación por 3 meses en pacientes con TVP distal de
pierna, no provocada, y posteriormente evaluar el riesgo beneficio de una
terapia a largo plazo.
En
persona con TVP de extremidad superior que involucre venas axilares o más
proximales, se recomienda anticoagulación y no trombolisis. En anticoagulante
recomendado es HBPM o fondaparinux en lugar de la HNF IV o SC.
En
paciente con TMS asociada a catéter venoso central (CVC), que esté funcional,
se recomienda anticoagular por lo menos 3 meses o el tiempo que permanezca el
catéter (lo que sea mayor) en los siguientes casos:, sin remover el catéter si
está funcional y existe la necesidad de su empleo.
Se
recomienda anticoagular por 3 meses si la trombosis se asocia a marcapasos o
implantes de desfibrilador y en personas sin cáncer que presentan la trombosis
posterior a la remoción del CVC.
Igualmente
en paciente con cáncer con TMS asociada a CVC, que es removido, se recomienda 3
meses de anticoagulación.
La
terapia anticoagulante en aquellos casos de TMS posterior al retiro de catéter
central en pacientes con cáncer activo se debe valorar de acuerdo a las
condiciones clínicas de la neoplasia y factores de riesgo para trombosis y
sangrado.
Pacientes
con una TMS no asociada a catéter central o cáncer, se recomienda terapia
anticoagulante por 3 meses.
Se recomienda la trombolisis guiada por
catéter en personas con TMS en los siguientes casos:
-
Síntomas graves
-
Trombosis que involucre la mayor parte de las vena subclavia y axilar
-
Síntomas menores de 14 días
- Buen
estado funcional
-
Expectativa de vida mayor de 1 año
- Bajo
riesgo de hemorragia
Se
continuará, posterior al procedimiento, con terapia anticoagulante semejante a
las no trombolizados.
No se
recomienda utilizar mangas de compresión ni medicamentos vasoactivos para
personas con TMS sintomática.
Sospechar
en persona con TMS no asociado a catéter central una alteración anatómica como
causa de trombosis como son: el síndrome de salida de torácica (SST) y la
trombosis inducida por esfuerzo (síndrome de Paget-von Schroetter).
La
persona con TMS asociada al SST se recomienda tratarla 3 meses de
anticoagulación con o sin tratamiento quirúrgico (resección de primera costilla
o escalenectomía).
¿Para la embolia pulmonar aguda
aplicar el tratamiento dirigido de acuerdo a la clínica tiene mejores resultados
que dar tratamiento general?
El
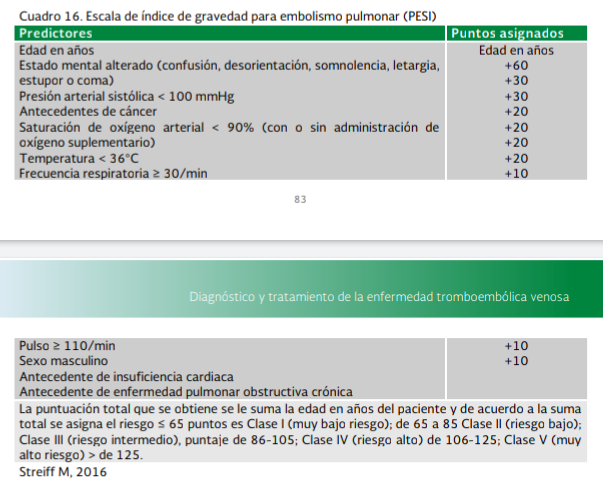
tratamiento de EP aguda va a depender de la estratificación del riesgo, el cual
se determina de acuerdo al riesgo de mortalidad a corto plazo. Esta
estratificación inicia identificando el estado hemodinámico del paciente, si
está en choque se clasifica como de alto riesgo o EP masiva con un riesgo
estimado de mortalidad a 30 días > 15%. Sí está hemodinámicamente estable
existen diversas escalas de evaluación para distinguir los de bajo riesgo
(<1%) de aquellos de riesgo intermedio (3–15%). Cuadros 16 y 17.
Para el
paciente con EP de alto riesgo el tratamiento de inicio es la terapia
trombolítica ya que permite resolver rápidamente la obstrucción con reducción
de la presión arterial pulmonar mejorando la función del ventrículo derecho.
Los resultados de un estudio sugieren que la mejoría clínica y por
ecocardiograma se incrementa en más del 90% de los pacientes que son tratados
con trombolisis.
Esta
terapia por lo general se utiliza en personas con EP de alto riesgo que tienen
inestabilidad hemodinámica sin alto riesgo de complicaciones hemorrágicas, sin
embargo faltan estudios clínicos controlados aleatorizados que soporten esta
evidencia.
Se
recomienda que al paciente con EP de alto riesgo, el tratamiento de inicio sea
la terapia trombolítica.
Recurrencia.
Se
recomienda valorar recurrencia de la ETV temprana, (primeras 2 semanas), sobre
todo en las personas con cáncer activo o que no alcanzan niveles terapéuticos
de anticoagulación.
Los
factores de riesgo independientes para recurrencia de la trombosis incluyen
edad avanzada, alto índice de masa corporal, sexo masculino, cáncer activo y
paresia de miembros inferiores. Otros factores predictivos son ETV no provocada,
anticoagulante lúpico o síndrome de anticuerpo antifosfolípido, deficiencia de
antitrombina, proteína S o C, hiperhomocistinemia, elevación persistente de
Dímero D (DD) en ETV no provocada y posiblemente trombosis venosa residual.
Se
recomienda vigilar datos de recurrencia, en especial en los primeros 6-12 meses
posterior a la trombosis. Es necesario vigilar estrechamente a
personas con edad avanzada, índice de masa corporal ≥30 Kg/m2, sexo masculino,
cáncer activo y paresia de miembros inferiores.
Existen
factores de riesgo que se presentan al momento de la ETV que están asociados
con una disminución del riesgo de recurrencia de trombosis o no son predictivos
de recurrencia como son embarazo o puerperio, anticonceptivos orales, terapia
hormonal o cirugía ginecológica. Otros factores son cirugía reciente, trauma o
fractura, inmovilización reciente, tratamiento con tamoxifeno.
Vigilar
factores de riesgo para la recurrencia como son presencia factores
protrombótico durante la ETV como:
- Obesidad
- Obstrucción de vena residual en ETV no provocada.
- DD elevado en trombosis no provocada independiente del punto de corto de la lectura 500 vs. 250 µg/L
- Condicionantes de falla a la anticoagulación como cáncer,
- SAAF, trombocitopenia inducida por heparina o síndromes de compresión vascular.
Se
recomienda documentar la recurrencia de la trombosis mediante los siguientes
parámetros:
- Afección de un territorio vascular no afectado previamente.
- Incremento del diámetro del trombo ≥4 mm, en caso de incremento del trombo entre 1 a 3.9 mm repetir la imagen en 1 semana.
- Una vez confirmada la recurrencia valorar la adherencia al tratamiento y, registrarlo en el expediente.
Se
recomienda la anticoagulación con las mismas indicaciones que un primer evento
por tres meses en una segunda trombosis espontánea y alto riesgo de hemorragia
Sí la
persona presenta trombosis recurrente recibiendo tratamiento anticoagulante con
un AVK a dosis terapéuticas o alguno de los AOAD, con buen apego, se recomienda
cambiar temporalmente a una HBPM. Si la recurrencia es con HBPM es necesario
incrementar la dosis, en una cuarta o tercera parte.
Se
recomienda una terapia anticoagulante indefinida en aquellos casos de trombosis
recurrente espontánea y riesgo de hemorragia bajo o moderado, con revaloración
periódica, cuando menos anual.
Personas
con ETV no provocada se recomienda considerar la anticoagulación de largo
plazo, así como la búsqueda de un estado trombofílico, para el caso de
trombosis provocada es importante determinar la permanencia del factor de
riesgo precipitante.
Síndrome
post trombótico
El
síndrome postrombótico (SPT) es una complicación a largo plazo que se presenta
entre 20 a 50% de las personas posterior a una TVP en un miembro, que se puede
presentar en pocos meses hasta algunos años después de la trombosis. Se
presenta en 1/3 de pacientes con TVP aguda y en más de 2/3 partes de pacientes
que tuvieron una TVP iliofemoral.
Se
recomienda realizar el diagnóstico de SPT con base a datos clínicos y después
de 6 meses de pasado el evento trombótico agudo. Utilizar las escalas
diagnósticas y de clasificación. Cuadro 18
Vigilar
datos de SPT especialmente en personas con edad avanzada (≥65 años), índice de
masa corporal >25, TVP recurrente ipsilateral, TVP extensa, que
presente incremento de los síntomas al mes o con anticoagulación subterapéutica
en el mes de la trombosis.
Se
recomienda la tromboprofilaxis primaria en persona con alto riesgo de TVP para
prevenir el SPT. Así también en el tratamiento inicial de la TVP es necesario
anticoagular con intensidad y duración adecuada.
Recomendamos
mantener monitoreo del INR regular y frecuente en persona con TVP anticoagulada
con AVK, especialmente en el primer mes de tratamiento.
Si la
persona con síntomas graves de SPT de miembro inferior que no mejora
adecuadamente con medias de compresión, se recomienda probar con medidas de
compresión intermitente.
El
tratamiento con fármacos vasoactivos como son el rutoside, defibrotide o
hidrosmine, no se recomienda para el tratamiento del SPT.
Se
recomienda un programa de ejercicios supervisado, para fortalecimiento de
pierna, y de actividad aeróbica, de por lo menos 6 meses, para pacientes con
SPT que toleren la actividad física.
Manejo
de ulcera venosa:
- Se
deben de utilizar medidas de compresión, en lugar de vendaje no compresivo o no
compresión.
- Los
sistemas de compresión multicomponente son más efectivos que los sistemas de un
solo componente.
- La
pentoxifilina puede ser útil para tratar las úlceras venosas con o sin
compresión.
- La
reconstrucción valvular se puede considerar en pacientes con ulceras venosas
postrombóticas refractarias.
Para el
manejo de úlcera venosa pos-trombótica se recomiendan medidas de compresión con
una mejor efectividad de los sistemas multicomponente.
La
pentoxifilina puede ser de utilidad con o sin medidas de compresión; en caso de
ulceras venosas postrombóticas crónicas se puede considerar el manejo
quirúrgico con reconstrucción valvular.
En
pacientes con SPT del brazo se sugiere el uso de bandas o mangas de compresión
con fines sintomáticos. No está recomendado el tratamiento con agentes vasoactivos.
Hipertensión
pulmonar
La
hipertensión pulmonar asociada a tromboembolismo pulmonar crónico (CTEPH).
Aunque poco frecuente, es una condición que pone en riesgo la vida con una
morbilidad y mortalidad considerable. Se considera que es el resultado de una
complicación a largo plazo de la embolia pulmonar que se caracteriza por la
falta de resolución del trombo por a consecuencia de uno o más episodios de EP
agudo.
La
hipertensión pulmonar por tromboembolia pulmonar crónica es una complicación de
la enfermedad tromboembólica venosa. A diferencia de otras clases
dehipertensión pulmonar, esta es potencialmente curable con cirugía
(tromboendarterectomía) o balón pulmonar por angioplastia.
Para el
diagnóstico los estudios de imagen tienen un papel central. La combinación de
técnicas como el gammagrama pulmonar, tomografía computarizada, y angiografía
por resonancia magnética, estas técnicas no invasivas dan información sobre la
anatomía y el funcionamiento. La angiografía pulmonar convencional con
cateterización del corazón derecho se considera como el estándar de oro para
diagnosticar la CTEPH.
Se
recomienda mantener vigilancia clínica en la fase de recuperación de una EP
aguda. Sospechar e investigar CTEPH si no hay una recuperación de la función
pulmonar, en especial a medio año de esta haberse presentado.Vigilancia
estrecha en persona con EP idiopática, EP previa o recurrente, o TEV previa con
elevación de la presión sistólica arterial al diagnóstico. Dar seguimiento al
perfil de lípidos, ancho de distribución de los eritrocitos, perfil tiroideo, y
diabetes mellitus.
Trombosis
asociada a cáncer, embarazo y uso de anticonceptivos
La TVP
asociada a cáncer, embarazo, puerperio y uso de anticonceptivos el abordaje de
prevención, diagnóstico y tratamiento es diferente que la relacionada a otros
factores?
Existe
asociación entre cáncer y trombosis. Los mecanismos implicados son: expresión
del factor tisular por células tumorales y propiedad protrombótica de la
mucina; así como factores asociados al cáncer; uso de catéteres intra venoso,
quimio o radioterapia, cirugía y complicaciones infecciosas.
En
cáncer activo, se recomienda mantener la terapia anticoagulante.
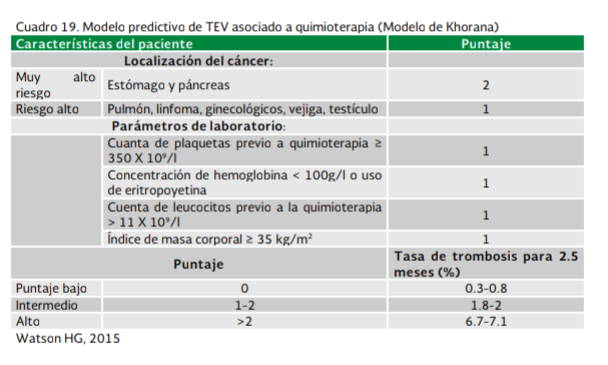
En el
paciente ambulatorio que recibe quimioterapia sistémica, se recomienda clasificar
el riesgo de trombosis en alto, intermedio o bajo de acuerdo a la información
validada por Khorana y cols. Cuadro 19
Se
recomienda realizar búsqueda de neoplasia primaria en casos de ETV no provocada
de acuerdo factores de riesgo específicos como sexo y edad, ej., realizar
colonoscopía en ≥50 años, mamografía en mujeres mayores de 40 a 50 años y
Papanicolau a mujeres entre 21 a 65 años.
En la
persona con cáncer y ETV se recomienda utilizar HBPM.
Se
sugiere la anticoagulación con HBPM en lugar de un AVK en persona con ETV
asociada a cáncer. Así como mantener la anticoagulación por más de 6 meses con
cáncer metastásico o que reciben quimioterapia. No existe suficiente evidencia
de superioridad en cualquiera de los AOAD como rivaroxaban, dabigatrán o
apixabán para su aplicación en pacientes no tratados con HBPM.
Terapia
inicial (fase aguda) ETV en personas con cáncer (PCC):
-HNF 80
UI/Kg. IV seguido de 18 UI/kg/h, ajustar dosis con TTPa.
-Dalteparina 100 U/Kg C/12 h. o 200 U/kg/día
-Enoxaparina
1 mg/Kg C/12 h. o 1.5 mg/Kg/ día
-Tinzaparina
175 U/Kg/día
-Fondaparinux
<50 Kg. 5.0 mg/día; 50-100 Kg. 7.5 mg/día; >100 Kg. 10 mg/día
Terapia
a largo plazo:
-Dalterapina
200 U/kg/día por 1 mes, después 150 U/kg/día.
-Enoxaparina
1.5 mg/kg/día o 1 mg/kg C/12 h.
-Tinzaparina
175 U/kg/día
-AVK
ajustar dosis para mantener INR entre 2 a 3. Se prefiere la HBPM sobre la HNF
para los primeros 5 a 10 días de anticoagulación en PCC y diagnóstico reciente
de ETV, sin afección renal grave (depuración de creatinina <30 ml/min.)
Tratamiento
de ETV en pacientes con cáncer (PCC) Terapia inicial (fase aguda):
-HNF 80
UI/Kg. IV seguido de 18 UI/kg/h, ajustar dosis con TTPa.
-Enoxaparina 1 mg/kg C/12 h. o 1.5 mg/kg/día
Terapia a largo plazo:
-Enoxaparina
1.5 mg/kg/día, o 1 mg/kg cada 12 h.
--AVK
ajustar dosis para mantener INR entre 2 a 3
Se
recomienda la terapia anticoagulante indefinida con HBPM o AVK en aquellos
casos de ETV asociado a cáncer activo y/o metastásico con riesgo de hemorragia
leve o moderada; para los que tienen alto riesgo de hemorragia la recomendación
es terapia extendida.
Considerar
la tromboprofilaxis en persona ambulatoria con cáncer activo y alto riesgo de
trombosis, considerando riesgo de hemorragia, estado y voluntad del paciente.
Persona
hospitalizada con cáncer activo o de reciente diagnóstico recibirá
tromboprofilaxis durante su permanencia en hospital en ausencia de hemorragia u
otra contraindicación, así como aquellos con algún padecimiento agudo o
reducción en su movilidad. La tromboprofilaxis no está recomendada sí la
persona está hospitalizada para procedimientos menores, infusión de
quimioterapia ambulatoria, o sometidos trasplante de médula ósea
Para
personas de bajo riesgo de trombosis con mieloma múltiple, que reciben
talidomida o lenalidomida con o sin dexametasona, se recomienda
tromboprofilaxis con aspirina o HBPM, y para aquellos con riesgo alto se
sugiere HBPM si no existe contraindicación. La anticoagulación a dosis
profiláctica o terapéutica no se recomienda para prevenir trombosis asociada a
catéter, ni para prolongar la sobrevida en PCC sin antecedente de ETV.
No se
recomienda la tromboprofilaxis en personas, sin antecedente de ETV, que reciben
terapia hormonal adyuvante para cáncer (tamoxifeno). Si se recomienda en los
casos de trombosis asociada a cáncer y que ameriten de terapia hormonal a largo
plazo y continuar con la anticoagulación el mismo lapso de tiempo del
tratamiento adyuvante
En PCC
sometido a cirugía mayor se considerará la tromboprofilaxis farmacológica, ya
sea con HNF o HBPM, la cual iniciará en el período preoperatorio. Un régimen
combinado de tromboprofilaxis (mecánico y farmacológico) mejora la efectividad,
especialmente en persona con alto riesgo de trombosis.
La
tromboprofilaxis farmacológica, para PCC sometida a cirugía mayor, se
continuará por lo menos 7-10 días. La profilaxis extendida con HBPM por más de
4 semanas pos operatorio. Se considerará en pacientes sometidos a cirugía
abdominal o pélvica por cáncer con factores de alto riesgo, restricción en la
movilidad, obesidad, antecedente de ETV. En las de bajo riesgo la duración de
la profilaxis se debe individualizar.
Se
recomienda en persona con cuenta de plaquetas entre 25 a 50,000/µL vigilancia
estrecha y valorar uso de HBPM. Plaquetas <50,000/µL es una contraindicación
relativa para la profilaxis farmacológica. En el período inmediato seguido de
la trombosis sí la cuenta de plaquetas <50,000/µL transfundir concentrados
plaquetarios (CP) para elevar la cifra a >50,000/µL, - En personas con cuenta
de plaquetas <25,000/µL está contraindicada la anticoagulación.
Se
recomienda que a la persona con ETV incidental (detectada por estudios de
gabinete) se le indique anticoagulación terapéutica. Valorar riesgo beneficio
para tratar trombosis esplénica o de venas viscerales.
Vigilar
datos de recurrencia de ETV en PCC activo sí la neoplasia está localizada en:
páncreas, cerebro, pulmón, ovario, y en casos de síndrome mieloproliferativo o
mielodisplásico, estadio IV, cáncer con progresión, paresia de miembro
inferior, sexo femenino y antecedente de ETV.
El
manejo de trombosis asociada a cáncer debe involucrar al equipo
multidisciplinario que brinda los cuidados oncológicos, valorando el riesgo
beneficio de hemorragia y/o retrombosis y considerando la voluntad de paciente
y familiares.
Trombosis
y embarazo
El
embarazo es un factor de riesgo independiente y adquirido para ETV a través de
los mecanismos fisiopatológicos para trombosis de la triada de Virchow: el más
importante es un estado pro-coagulante en preparación para el parto mediante un
incremento de la generación de fibrina, de los factores de coagulación II, VII,
VIII, X y de von Willebrand, y una reducción de los mecanismos anticoagulantes
(resistencia adquirida a la proteína C activada, disminución de la actividad de
la proteína S y antitrombina) y una inhibición de la fibrinolisis mediante el
incremento en los inhibidores del activador del plasminógeno 1 y 2. La estasis
vascular es resultado de la vasodilatación por efecto de la progesterona y por
la obstrucción del flujo venoso por el útero grávido hacia las venas iliacas y
cava inferior, por último el daño endotelial puede ocurrir al momento del parto
o por hipertensión venosa
Se
recomienda vigilar datos de TVP en la embarazada, en especial, en las 2 semanas
previas al parto y en las 6 primeras semanas del postparto.
Se
recomienda investigar en embarazada factores de riesgo y consignarlos en el
expediente. Valorar los pre-existentes al embarazo como antecedente familiar o
personal de trombosis y diagnóstico previo de trombofilia, así como
hipertensión (probablemente por pre eclampsia), inmovilidad y cesárea.
Los
síntomas de TEP son los mismos que para mujeres no embarazadas: disnea (87%),
dolor pleurítico (61%), taquicardia, taquipnea, hipoxemia, hemoptisis, síncope,
tos e hipotensión inexplicable.
Durante
el embarazo se recomienda documentar edema unilateral de miembros inferiores,
medir diámetro de circunferencia a nivel de músculos gemelos, sospechar
trombosis si la diferencia es > 2cm. Cuando existe dolor a nivel de glúteos,
ingle o abdomen, considerar trombosis de vena iliaca. No aplicar los criterios
clínicos de Wells.
Se
recomienda sospechar TEP en presencia de disnea, dolor pleurítico, taquicardia,
taquipnea, hipoxemia, hemoptisis, síncope, tos e hipotensión inexplicable.
Ante la
sospecha clínica de TVP se recomienda realizar ultrasonido de compresión
completa (UCC) de miembro inferior. Si es negativo o inconcluso, se recomienda
repetir en 3 a 7 días. Para valoración de venas ilíacas el USG Doppler a color
es la técnica recomendada. Si la sospecha clínica es de trombosis de vena
iliaca y con el ultrasonido no se concluye el diagnóstico, se recomienda la
venografía con resonancia magnética sin contraste y de manera muy restringida.
Para el
diagnóstico de TEP en el embarazo se recomienda realizar estudios de
angiografía por tomografía axial computarizada (ATAC) y el gammagrama de
ventilación/perfusión (gV/P). El gV/P se recomienda a dosis bajas de perfusión
en embarazada con radiografía de tórax normal. Si la radiografía de tórax es
anormal y no se dispone del gV/P o no es concluyente se realiza la ATAC.
Ninguno de estos estudios está contraindicado categóricamente.
Debido
al incremento fisiológico del dímero D durante el embarazo, un resultado
negativo será menos probable en este grupo. Utilizando los rangos de referencia
convencionales para no embarazadas, un resultado de dímero D normal excluye el
diagnóstico de ETV con la misma probabilidad en la mujer embarazada. Hasta el
momento no se ha determinado un nivel de corte máximo de dímero D en el
embarazo por lo que no debe de utilizarse de manera aislada para descartar la
trombosis.
Se
recomienda excluir el diagnóstico de ETV sí el resultado de dímero D es normal.
Los
AOAD (rivaroxaban, dabigatrán, apixaban, edoxaban) pueden cruzar la barrera
placentaria y son secretados en leche materna por lo que no son una opción
durante el embarazo o lactancia.
Se
recomienda utilizar las HBPM para la ETV durante el embarazo y puerperio. En
caso de contraindicación utilizar HNF como alternativa, en casos con alto
riesgo de hemorragia, insuficiencia renal o durante la fase inicial del manejo
de TEP confirmada y descompensación hemodinámica candidatas a trombolisis. No
utilizar AVK en el embarazo, pero si en la lactancia. Los AOD se pueden
utilizar durante el embarazo y lactancia.
Se
recomienda el uso de HBPM a dosis terapéuticas para el tratamiento agudo de ETV
durante el embarazo. Enoxaparina aplicación subcutánea 1.5 mg/Kg/día o 1 mg/Kg
C/12 h El tratamiento anticoagulante con HBPM continuará en el trascurso del
embarazo y puerperio a misma dosis terapéutica y solo se puede considerar el
uso de dosis intermedias en caso de alto riesgo de hemorragia o bajo riesgo de
re-trombosis
La HNF
se puede utilizar cuando exista alguna ventaja sobre las HBPM como son:
- ETV
después de las 36 SEG
-
Sospecha o TEP masiva confirmada
- Alto
riesgo de hemorragia
-
Insuficiencia renal
Se
recomienda el uso de HNF en mujeres embarazadas solo en estas condiciones:
- ETV
después de las 36 SEG
-
Sospecha o TEP masiva confirmada
- Alto
riesgo de hemorragia
-
Insuficiencia renal
La
dosis inicial IV es de 80 UI/Kg, seguido de infusión continua de 18 U/Kg/h con
monitoreo a las 4-6 h del bolo inicial y después de cada cambio de la dosis de
infusión. Mantener el TTPa de 1.5 a 2.5 por encima del valor control. Se puede
aplicar de manera subcutánea C/12 h, con monitoreo del TTPa a las 4-6 h de
aplicada la inyección y posterior a cada cambio de dosis.
En la
embarazada anticoagulada por ETV, se recomienda la resolución del embarazo por
parto vaginal. La cesárea solo se recomienda para casos con una clara
indicación obstétrica
Se
recomienda suspender la HBPM 24 hrs. antes de la inducción electiva del período
de labor o de cesárea, o en cuanto inicie el período de labor (ruptura de
membranas o inicio de contracciones). A partir de las 37 SEG se recomienda
aplicación de HBPM C/12 hrs. Se recomienda una dosis profiláctica o
intermediaria de heparina (HNF) en caso de proceso de labor prolongado y un
riesgo de retrombosis alto y considerando el tiempo probable para el parto
En la
embarazada con terapia anticoagulante a dosis terapéuticas está contraindicada
la anestesia neuroaxial. Se recomienda suspender la HBPM por lo menos 24 h
antes de la punción y reiniciarla 4 h después de su retiro.
En el
caso de utilizar HNF intravenosa, se suspenderá 4 a 6 h previo a la punción, y
de 8 a 12 hrs. sí la aplicación fue SC, y con TTPa normal. La HNF se puede
reiniciar después de 1 h de retirado el catéter o de 4 a 6 hrs. después del
parto si no hay complicaciones hemorrágicas. Se recomienda vigilancia estrecha
para detectar hematoma espinal.
Anticoagulación post-parto
Dependiendo
de las pérdidas sanguíneas y el riesgo de retrombosis, se recomienda reiniciar
la terapia anticoagulante no antes de 6 a 12 hrs. después de parto vaginal y de
12 a 24 hrs. posterior a una cesárea. La anticoagulación se puede realizar con
HBPM con ajuste de dosis de acuerdo al peso de la mujer pos-parto o con warfarina,
una vez que el sangrado vaginal ha disminuido y utilizando ambos medicamentos
(HBPM y warfarina) por un lapso de 3 a 5 días hasta obtener un INR terapéutico
entre 2.0 a 3.0.
Se
recomienda una terapia anticoagulante de por lo menos 6 semanas pos-parto y una
duración mínima total de anticoagulación de 3 meses. Para mujeres de alto
riesgo y con persistencia de los factores de riesgo se sugiere una profilaxis
por más de 6 semanas posteriores al parto.
Profilaxis de ETV y embarazo
El
colegio americano de médicos de tórax (ACCP, por siglas en inglés) recomienda
la profilaxis con HBPM a todas las embarazadas con antecedente de ETV y
trombofilia documentada, así como aquellas con antecedente de >2 eventos de
TVP.
Se
recomienda tromboprofilaxis durante el embarazo y puerperio con HBPM en mujeres
con antecedente de ETV y trombofilia documentada y/o más de 2 eventos de TVP.
Con
antecedente de un evento de TVP sin trombofilia o con un factor de riesgo para
trombosis transitoria se recomienda vigilancia durante el embarazo y profilaxis
postparto
Se
recomienda la anticoagulación post-parto en mujeres con trombofilia,
hereditaria o adquirida, sin antecedente de ETV, con vigilancia estrecha previa
al parto. Solo en casos documentados de deficiencia de antitrombina se dará
tromboprofilaxis en el embarazo y puerperio.
Profilaxis
de ETV en embarazadas con trombofilia sin antecedente de trombosis: Las
trombofilias hereditarias incrementan el riesgo de ETV asociada a embarazo
hasta 34 veces con mayor riesgo durante las 6 semanas post-parto. Un reciente
meta análisis actualizó el riesgo de un primer evento trombótico asociado a
embarazo en mujeres con trombofilia ya documentada.
Con
base a este meta análisis se recomienda tromboprofilaxis en embarazadas con
trombofilia sin antecedente de trombosis, en las siguientes condiciones: Antes
del parto y hasta 6 semanas pos-parto en deficiencia de antitrombina y proteína
C, mutación del factor V de Leiden (homocigotas), con antecedente familiar de
trombosis y con factores de riesgo adicionales para ETV. Deficiencia de
proteína S y antecedente familiar de trombosis venosa se utilizará la
tromboprofilaxis con HBPM hasta por 6 semanas post-parto A las heterocigóticas
para el factor V de Leiden o para la mutación 20210 del gen de protrombina se
recomienda solo vigilancia.
Se
recomienda detección de Síndrome de Anticuerpos Antifosfolípido (SAAF):
pérdidas de producto temprano (tres o más abortos antes de la semana 10 de
gestación. A la embarazada que reúne los requisitos para diagnóstico de SAAF,
se recomienda antes del parto la administración de dosis profilácticas o
intermedias de heparina no fraccionada o dosis profiláctica de HBPM combinada
con aspirina de 75 a 100 mg/día.
Se
recomienda en embarazada sometida a cesárea valorar riesgo de trombosis para
dar tromboprofilaxis. Sin factores de riesgo sólo deambulación temprana. Con un
factor de riesgo mayor o dos menores, dar HBPM, y sí tienen contraindicación de
anticoagulantes, se dará profilaxis mecánica (medias elásticas o compresión
neumática intermitente) mientras permanece hospitalizada. Con múltiples
factores de riesgo que persisten en el puerperio, la profilaxis será combinada
(HBPM y medias elásticas y/o compresión neumática intermitente).
Se
recomienda que en mujeres anticoaguladas con un AVK por ETV y se embarazan
cambiar a HBPM.
A la
mujer que toma un AVK e intenta embarazarse, se recomienda realizarle prueba de
embarazo frecuente y cambiar a HBPM tan pronto se confirme el embarazo. La que
usa dosis bajas de aspirina y desea dar seno materno puede continuar con este
medicamento.
Para
prevención de tromboembolismo en embarazada con válvula cardiaca mecánica se
recomienda cualquiera de los siguientes esquemas anticoagulantes:
a)
Dosis ajustadas de HBPM, dos veces al día obteniendo el pico de anti factor Xa
señalado por el proveedor a la 4 h posterior a la administración SC.
b)
Dosis ajustada de HNF administrada SC cada 12 h, manteniendo TTPa al doble del
control o un nivel de heparina anti factor Xa de 0.35 a 0.70 U/ml.
c) HNF
o HBPM hasta la semana 13, con sustitución de AVK hasta cerca al embarazo,
cuando la HNF o HBPM se reinicia.
Se
recomienda que durante el embarazo, si existe alto riesgo de tromboembolismo y
poca respuesta a HNF o HBPM a dosis terapéuticas, cambiar a un AVK, y cercano a
la resolución del mismo remplazarlo por HNF o HBPM. Adicionar aspirina a dosis
de 75 a 100 mg/día, si tiene prótesis valvular con alto riesgo de
tromboembolismo.
Valorar
con precaución utilizar filtros de VCI para prevenir TEP durante el embarazo.
El uso
de filtro de VCI durante el embarazo deberá ser evaluado por un equipo
multidisciplinario de atención obstétrica y su colocación por personal
experimentado.
No
existe evidencia suficiente para recomendar la trombolisis dirigida por catéter
durante el embarazo o puerperio y sólo se puede considerar en aquellos casos en
que la trombosis ponga en riesgo la vida de la paciente o la integridad de una
extremidad, posterior al manejo conservador de anticoagulación y/o la
colocación de filtro en VCI.
Se
recomienda tomar en cuenta el riesgo-beneficio para madre y producto en
aquellos casos de ETV que no responda al tratamiento conservador y que requiera
de procedimientos invasivos o de exposición a radiación, para tomar la mejor
decisión terapéutica mediante la participación informada de pacientes y
familiar.
Trombosis
y terapia hormonal
Se
recomienda que en caso de indicar el uso de un AOC se utilice el de menor
riesgo de trombosis, como es levonorgestrel con 30µg de etinilestradiol.
Se
recomienda, indistintamente, los anticonceptivos en parche, anillo vaginal y
AOC. Así como los que contienen solo progestágeno ya sea vía oral
(levonorgestrel 1.5 mg “píldora del día siguiente”), inyectables, implantes o
de manera intrauterina.
Se
recomienda el uso de anticonceptivos a base de progestágenos en la mujer con
antecedente de ETV o que estén cursando con un evento trombótico de tipo
venoso.
Se
recomienda que la mujer que desee utilizar AOC, se le indique iniciarlo después
del primero o segundo trimestre posterior al parto, con una contraindicación
clara en los primeros 21 días del puerperio
Se
recomienda utilizar métodos anticonceptivos con solo progestágenos en mujer
mayor de 35 años, fumadora activa o con menos de 1 año de haber suspendido el
hábito, o con IMC ≥ 35 Kg. En estos casos está contraindicado utilizar AOC.
Se
recomienda que sí la mujer toma AOC y será sometida a un procedimiento electivo
de cirugía mayor que requiera inmovilización prolongada, suspenderlo y utilizar
un método anticonceptivo sin estrógenos por lo menos 4 semanas antes de la
cirugía. No es necesario sí la cirugía es menor sin inmovilización. En cirugía
mayor de urgencia valorar la tromboprofilaxis mecánica o farmacológica.
En la
mujer con trombofilia primaria se recomienda algún método anticonceptivo con
sólo progesterona. Está contraindicado utilizar AOC.
El
filtro de vena cava inferior (VCI) se ha utilizado en pacientes con TVP aguda
proximal de miembro inferior (<4 meses) y contraindicaciones absoluta para
el uso de anticoagulantes
Las
principales indicaciones son:
Hemorragia
mayor que ponga en riesgo la vida, no reversible con intervención quirúrgica o
médica, incluyendo en sitios críticos (intracraneal, pericárdico,
retroperitoneal, intraocular, intra-articular, intraespinal).
-Hipertensión
maligna
-Coagulopatía
descompensada (ej., falla hepática)
-Disfunción
plaquetaria grave o coagulopatía hereditaria
-Trombocitopenia
grave persistente (<20,000/µL)
-Cirugía
o procedimiento invasivo, incluyendo punción lumbar, anestesia espinal y/o
colocación de catéter epidural.
En el
paciente TVP aguda proximal de miembro inferior (< 4 meses) y
contraindicación absoluta para terapia anticoagulante, se recomienda, valorar
de manera estricta, colocar filtro en vena cava inferior (VCI). En especial en
los casos de hemorragia mayor que ponga en riesgo la vida o la función, no
reversible con intervención quirúrgica o médica, hipertensión maligna,
coagulopatía descompensada disfunción plaquetaria grave o coagulopatía
hereditaria, trombocitopenia grave persistente (<20,000/µL), cirugía o
procedimiento invasivo (punción lumbar, anestesia espinal y/o colocación de
catéter epidural)
Se
recomienda remover el filtro una vez resuelta la contraindicación para la
anticoagulación y dar terapia anticoagulante de acuerdo a las características
del paciente.
Vigilar
complicaciones asociadas al filtro de VCI como hematoma o TVP sobre el sitio de
inserción, migración, erosión a través de la pared de la vena cava,
embolización del filtro y trombosis/obstrucción de VCI. No se recomienda el uso
de filtro de VCI para TVP distal, tromboflebitis superficial, ETV mayor de 1
mes o TVP de miembro superior
Se
recomienda que la colocación de filtro de VCI la realice personal capacitado y
valorando riesgo-beneficio de cada caso clínico específico.





































No hay comentarios.:
Publicar un comentario